近日,武汉大学病毒学国家重点实验室陈宇/蓝柯/徐可研究组合作,在国际学术期刊Emerging Microbes & Infections在线发表了题为“The lethal K18-hACE2 knock-in mouse model mimicking the severe pneumonia of COVID-19 is practicable for antiviral development”的研究论文,报道了一种新型K18-hace2敲入(KI)转基因小鼠模型。论文系统地比较了三种hACE2基因工程小鼠(K18-hACE2 KI、K18-hACE2 Tg和HFH4-hACE2 Tg小鼠)感染SARS-CoV-2后的症状,并在K18-hACE2 KI小鼠中评估了SARS-CoV-2 WT、Delta和Omicron等毒株的致病性,同时也评估了该小鼠模型在抗新冠病毒药物和疫苗开发中的适用性。

大多数新冠肺炎患者的临床症状较轻,预后良好。然而一些患者可能会迅速发展为严重的综合征,如肺炎、急性呼吸窘迫综合征(ARDS)和多器官衰竭,这可能导致患者死亡。因此,研究COVID-19重症的具体发病机制,开发药物和疫苗,以降低COVID-19的发病率和死亡率,有重要意义。而合适的动物模型对COVID-19研究至关重要。目前已有的大多数动物模型,如仓鼠、雪貂、树鼩和非人灵长类等中的SARS-CoV-2致病性仅为轻度至中度病毒性疾病。与这些动物模型相比,小鼠模型具有易于使用、高可用性和成本效益的理想特征。因此,开发一种能够模拟COVID-19严重疾病表型和致命临床过程的小鼠模型,对新冠研究有重要价值。
研究人员利用CRISPR-Cas9技术,将K18启动子驱动的人ACE2基因敲入小鼠的hip11位点,构建了稳定表达人ACE2的转基因小鼠(K18-hACE2 KI mouse)。为了评估该小鼠模型对SARS-CoV-2的敏感性,研究人员利用之前已有报道的K18-hACE2 Tg和HFH4-hACE2 Tg小鼠,与K18-hACE2 KI小鼠一同进行了SARS-CoV-2感染实验。实验结果显示,低剂量的SARS-CoV-2 WT(2.5×102 PFU)可有效感染K18-hACE2 KI小鼠且造成严重的肺部损伤和100%的死亡率,而低剂量病毒感染K18-hACE2 Tg小鼠和HFH4-hACE2 Tg小鼠的肺损伤有限,三分之一的K18-hACE2 Tg小鼠感染后死亡,六分之一的HFH4-hACE2 Tg小鼠感染后死亡。这些数据表明我们基于K18-hACE2 KI小鼠构建的小鼠感染模型是一种模拟COVID-19重症肺炎的致死性模型,对SARS-CoV-2感染更敏感(图1)。
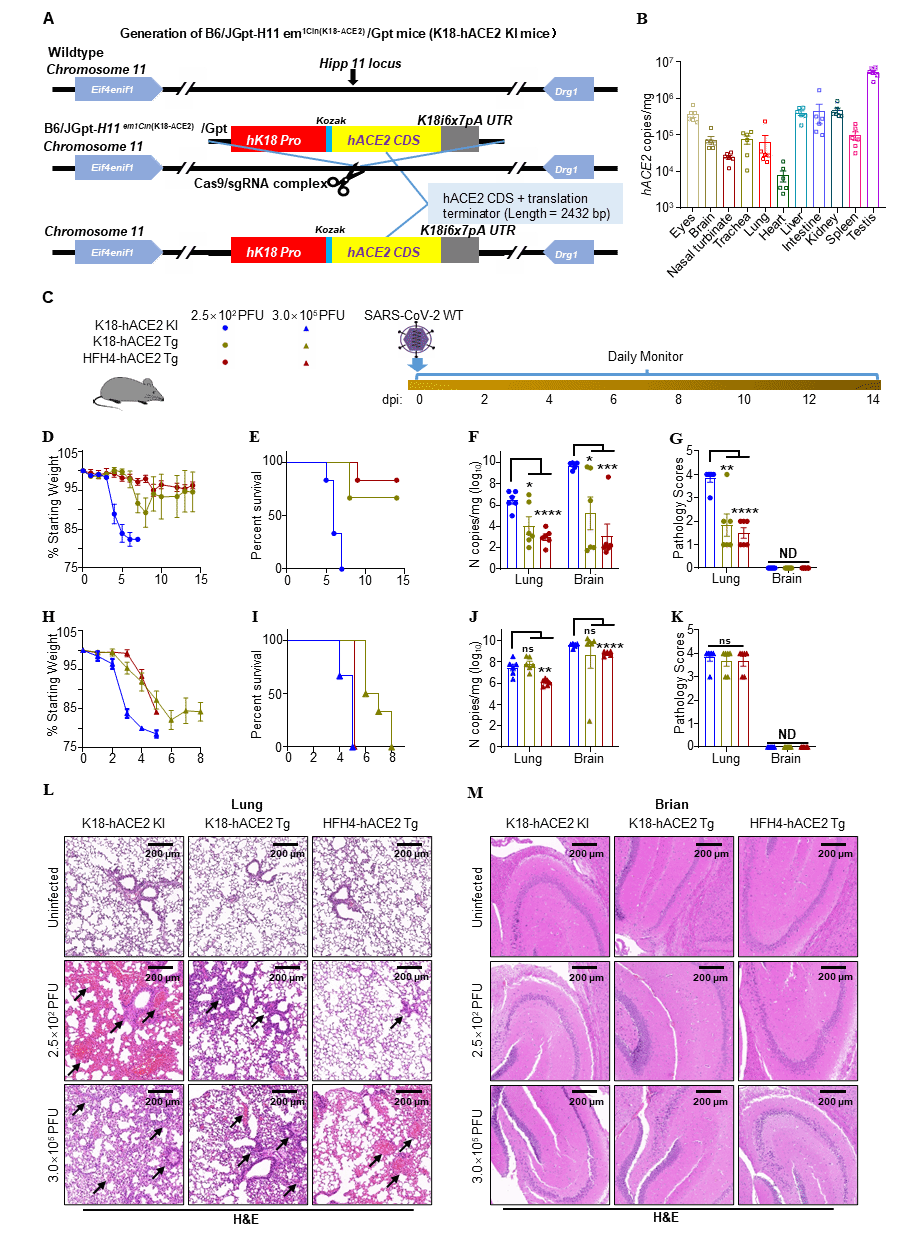
图1.三种hACE2转基因小鼠SARS-CoV-2感染模型的比较
研究人员通过多个采样点,进一步表征了SARS-CoV-2 WT在K18-hACE2 KI小鼠中的致病机制。实验结果显示,SARS-CoV-2可以在K18-hACE2 KI小鼠的肺和脑中建立强大而稳定的感染和复制,在250-3x105PFU的感染范围内,SARS-CoV-2 WT感染的致死率均为100%(图2)。组织学分析表明,随着感染的进展,K18-hACE2 KI小鼠的肺炎由轻到重逐渐发展,而小鼠的脑部未发现明显的组织损伤。进一步检测结果显示,感染SARS-CoV-2的K18-hACE2 KI小鼠在肺部出现了严重的炎症细胞因子和趋化因子反应,且呈感染剂量依赖性,与肺部病理特征一致。相比之下,小鼠在大脑中表现出较弱的炎症细胞因子反应和较强的趋化因子反应,但是没有可检测到的脑部病理改变。研究人员推测在K18-hACE2 KI小鼠中,组织特异性病理和免疫反应主导了疾病的严重程度。SARS-CoV-2在K18-hACE2 KI小鼠中的致死率与严重的肺部病理和肺部炎症反应密切相关。

图2. SARS-CoV-2感染K18-hACE2 KI小鼠导致致命感染。
SARS-CoV-2自2019年底暴发以来,持续传播与变异并导致突变株(Alpha、Beta、Gamma、Delta和Omicron)的出现,这些突变株的在人群中表现出了不同的致病性。研究人员进一步在K18-hACE2 KI小鼠中评估了SARS-CoV-2 WT、Delta、Omicron BA.1和Omicron BA.2等毒株的致病性。与感染WT病毒的小鼠相比,感染Delta或Omicron BA.1的小鼠从4 dpi开始体重明显下降,大约延迟了2天,而感染Omicron BA.2小鼠从6 dpi开始体重明显下降。感染BA.2的小鼠有40%在12 dpi时死亡,其余存活。不同毒株感染小鼠的肺部病毒载量在终点时没有显著差异。病理分析发现,在WT、Delta、BA.1和BA.2感染小鼠肺部,肺血管周围均有单核细胞、中性粒细胞和淋巴细胞浸润,肺泡壁细胞变性,但BA.1感染和BA.2感染的肺部炎症细胞数量和肺泡壁厚度明显少于WT感染的肺部,提示SARS-CoV-2的致死率与严重的肺部病理和炎症反应密切相关(图3)。
图3. SARS-CoV-2 WT、Delta、Omicron BA.1和Omicron BA.2毒株在K18-hACE2 KI小鼠中的致病性。
最后,为了评估K18-hACE2 KI小鼠在抗SARS-CoV-2药物开发中的潜力,研究人员利用该小鼠模型测试了四种抗病毒药物和一种疫苗: REGN10933、人源单抗4G4、Remdesivir (RDV)、Nirmatrelvir (NMV)和mRNA疫苗。用REGN10933治疗的小鼠在4 dpi后体重急剧下降,75%的小鼠在8 dpi时死亡。接受4G4、NMV或mRNA疫苗治疗的小鼠均存活,且未观察到明显的体重变化。与对照组相比,REGN10933、4G4、NMV和疫苗显著降低了肺中的病毒载量。肺病理分析显示, REGN10933组和RDV组均出现严重间质性肺炎,注射4G4、NMV或疫苗的小鼠只观察到轻微的病变。考虑到REGN10933和RDV在其他SARS-CoV-2感染动物模型中的抗病毒效果更好,这些结果表明K18-hACE2 KI小鼠模型对抗SARS-CoV-2药物和疫苗的评估是可行和严格的(图4)。
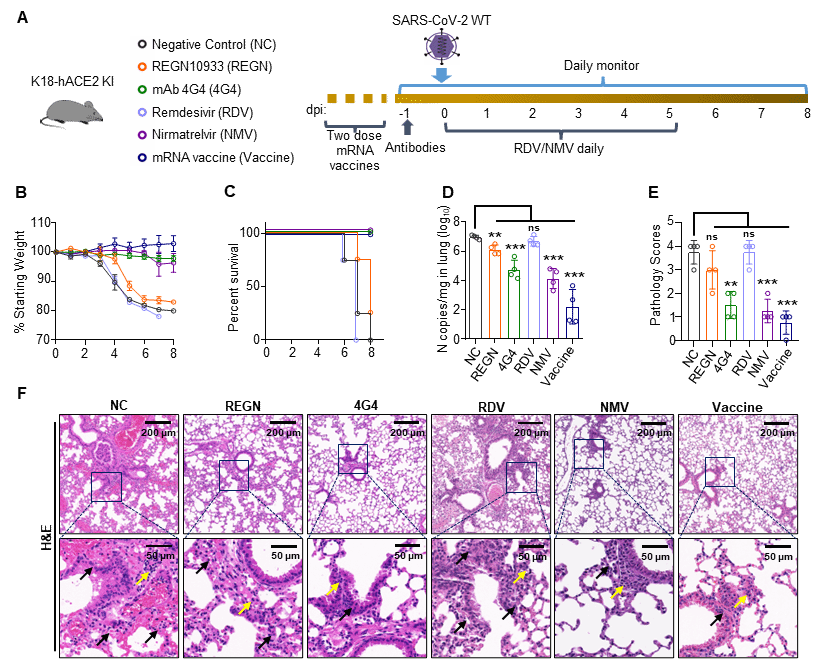
图4.利用K18-hACE2 KI小鼠模型评价抗SARS-CoV-2药物和疫苗。
整体而言,K18-hACE2 KI小鼠是一种有吸引力的动物模型,可用于理解SARS-CoV-2的传播和发病机制,并了解人类感染SARS-CoV-2的临床表现。这一致死性小鼠模型也对评估SARS-CoV-2疫苗和药物有重要价值,为SARS-CoV-2疾病发病机制的研究提供了新的思路。武汉大学病毒学国家重点实验室陈宇教授、蓝柯教授和徐可教授为该论文共同通讯作者。武汉大学动物实验中心/ABSL-Ⅲ实验室实验师张贞、周立副教授和病毒学国家重点实验室刘乾运博士为该论文共同第一作者。该研究得到了国家重点研发项目、国家自然科学基金、中央高校基本科研业务费和湖北省自然科学基金等项目的资金资助。