2024年4月16日,武汉大学病毒学国家重点实验室张军杰教授研究组在国际学术期刊PLOS Pathogens上在线发表题为“Palmitoylation of KSHV pORF55 is required for Golgi localization and efficient progeny virion production”的研究论文,揭示了卡波氏肉瘤相关疱疹病毒(KSHV)病毒蛋白ORF55在裂解复制中发挥的关键作用。
KSHV是一种人类肿瘤疱疹病毒,其感染可引起卡波氏肉瘤、原发性渗出性淋巴瘤等多种恶性肿瘤。KSHV编码超过80种病毒蛋白,其中许多病毒蛋白在病毒复制中的作用尚不清楚,特别是对于病毒组装释放过程,我们更是知之甚少。在疱疹病毒组装的过程中,需要进行两次囊膜化。在细胞核中组装好的病毒衣壳与细胞核膜相互作用,完成第一次囊膜包被和去包被,然后进入细胞质进行二次包膜。对于KSHV病毒蛋白如何调控二次包膜进而促进病毒组装,我们的认识还非常有限。
在该研究中,作者们针对研究较少的裂解期病毒基因进行了小规模的CRISPR敲除筛选,发现ORF55敲除极大地抑制了子代病毒粒子的产生。作者们通过人工染色体重组技术获得了ORF55敲除病毒,发现ORF55敲除病毒诱导裂解复制后产生的子代病毒粒子数量同样显著降低,但病毒转录、复制水平以及即早期和早期蛋白表达并不受影响,提示ORF55在病毒裂解复制后期发挥作用。进一步研究发现,ORF55定位于细胞的高尔基体,且ORF55 N末端的第10位和第11位半胱氨酸的棕榈酰化对其高尔基体定位至关重要。当这两个半胱氨酸中的任意一个突变后,ORF55均丧失其高尔基体定位,相应突变病毒的子代病毒粒子数量也显著降低。通过电镜观察病毒形态发现,在ORF55 KO或棕榈酰化位点突变后,病毒在组装过程中不能形成二次包膜。有趣的是,当在ORF55棕榈酰化位点突变体前面融合表达一段高尔基体定位序列,人为回复其高尔基体定位,可以完全回复子代感染性病毒粒子水平,表明ORF55 N末端棕榈酰化导致的高尔基体定位对其发挥促进组装释放的作用至关重要。进一步研究发现,ORF55棕榈酰化位点突变体的稳定性明显下降,经由蛋白酶体降解。此外,无论ORF55是否定位于高尔基体,其泛素化水平都很高,表明ORF55在细胞内高度泛素化,而其高尔基体定位有助于稳定ORF55,使其能够发挥促进病毒组装的作用。
该研究不仅揭示了肿瘤疱疹病毒KSHV病毒蛋白ORF55在病毒组装过程中的关键作用,还提示了特异性抑制病毒蛋白的棕榈酰化可能是一种有效的抗病毒治疗策略。通过阻断ORF55的棕榈酰化,可以干扰病毒的组装和释放过程,为开发新型的抗病毒药物提供了理论基础。
武汉大学医学研究院2021级博士研究生周亚茹为该论文的第一作者,武汉大学医学研究院、免疫与代谢前沿科学中心、病毒学国家重点实验室张军杰教授为该论文的通讯作者。该研究的合作者包括武汉大学病毒学国家重点实验室蓝柯教授和白磊博士,武汉大学医学研究院蒋白山教授,中国科学院武汉病毒所罗敏华研究员和汕头大学覃青松教授。研究获得国家重点研发计划、国家自然科学基金、中央高校基本科研业务费专项资金及病毒学国家重点实验室自主科研项目等资助。
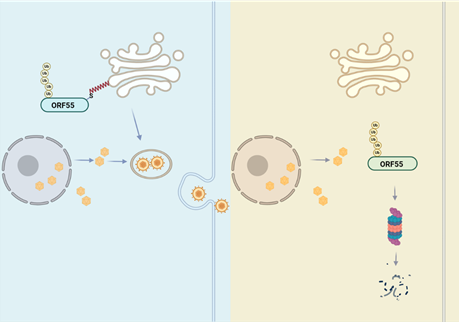
示意图:KSHV病毒蛋白ORF55棕榈酰化修饰后定位于高尔基体,促进病毒的二次包膜组装过程。当ORF55不能被棕榈酰化修饰时,失去了定位于高尔基体的能力,而定位于细胞质,同时受到高度泛素化修饰,进入蛋白酶体降解。
论文链接:https://journals.plos.org/plospathogens/article?id=10.1371/journal.ppat.1012141