近日,国际学术期刊PLoS Pathogens 在线发表了病毒学国家重点实验室的陈宇研究组的最新研究成果,论文题为“NSUN2-mediated m5C modification of HBV RNA positively regulates HBV replication”。该研究工作揭示了宿主m5C甲基转移酶NSUN2可以介导HBV RNA上的m5C修饰,从而增加病毒RNA的稳定性,促进HBV病毒的复制与表达。

尽管有强有力的预防与治疗措施,乙肝病毒的慢性感染仍是引起肝硬化以及导致肝癌的主要原因。目前,围绕HBV表观调控的研究方兴未艾,如HBV的cccDNA水平表观修饰以及RNA水平m6A修饰已成为最近的研究热点。HBV RNA上的m6A修饰在HBV生命周期中发挥着复杂的调控作用。
除m6A修饰外,5-甲基胞嘧啶(m5C)也是真核生物mRNA上的另一种重要修饰。而目前为止,由于测序技术的限制,m5C修饰调控病毒的研究并不广泛。在该研究中,研究人员首先探索了m5C甲基转移酶和去甲基转移酶在HBV生命周期中的作用。结果显示,m5C甲基转移酶NSUN2缺失负调控HBV的复制,而m5C去甲基转移酶TET2缺失正调控HBV的复制。随后研究人员创新性地结合重亚硫酸盐体外测序和细胞水平高通量测序两种方法,鉴定比较了HBV RNA上m5C修饰的分布和水平。

图1 HBV RNA重亚硫酸盐体外测序
体外测序结果显示(图1),有3个位点的甲基化水平在60%以上,其他的位点甲基化水平从10%-40%不等。这三个位点分别为C131,C2017,C2268。
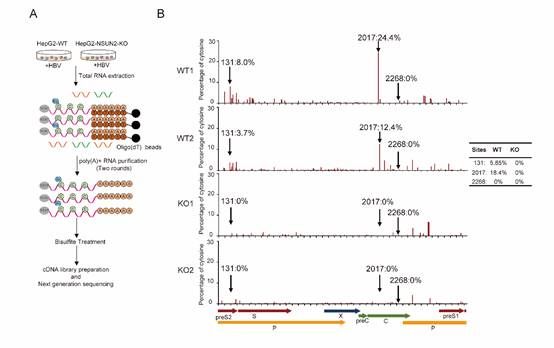
图2 HBV RNA重亚硫酸盐细胞水平高通量测序
为了确认以上位点在细胞水平或生理条件下是否也为NUSN2蛋白的靶点以及进一步获得HBV RNA在生理条件下的甲基化分布及水平,研究人员使用重亚硫酸盐高通量测序对细胞内HBV RNA上m5C的修饰水平进行分析。结果显示(图2),其中甲基化水平最高的两个位点为C2017和C131,在NSUN2敲除后甲基化水平变为0%。但是C2268位点的甲基化水平在NSUN2敲除前后均为0%,这说明C2268位点是一个“假”m5C修饰位点,即在生理条件下并不存在。这表明相比于体外测序,体内测序技术更能反应真实的甲基化水平,而体外测序可以用作预实验进行筛选。
随后对这两个位点进行突变,结果显示C2017A和C131T突变会导致HBV的复制和表达显著降低。进一步分析发现NSUN2介导的m5C修饰可以促进HBV RNA的稳定性。此外,基于HepG2-NTCP细胞和原代人类肝细胞(PHHs)的HBV感染系统(图3和4),研究人员发现NSUN2敲低后,HBV的感染和复制水平显著下降,并且突变病毒在HepG2-NTCP细胞和PHHs中感染和复制的能力显著下降。最后研究人员在C57BL/6JGpt-Nsun2+/-小鼠中获得相同的结论。有趣的是,研究人员还发现HBV感染和核心蛋白可以促进内源NSUN2的表达,表明可能存在一个正向反馈环路。
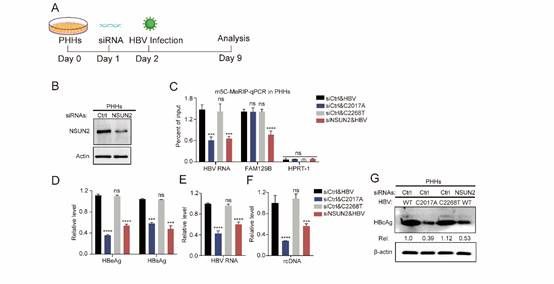
图3 原代肝细胞感染系统证实NSUN2正调控HBV复制
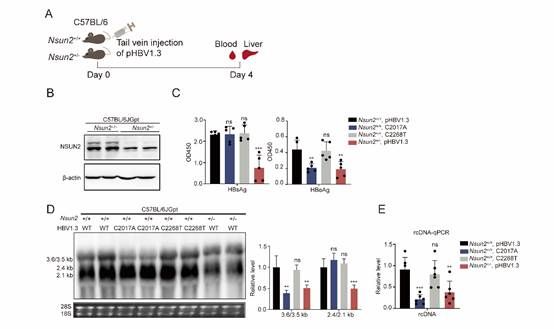
图4 小鼠水平证实NSUN2正调控HBV复制
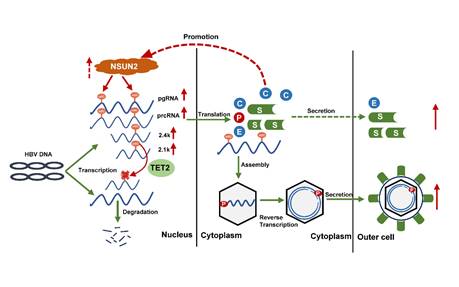
总之,该研究为我们展示了准确且单碱基分辨率的HBV RNA上的m5C分布图谱,并揭示了NSUN2介导的HBV RNA上的m5C修饰通过维持RNA稳定性来正向调控HBV的复制(图5)。
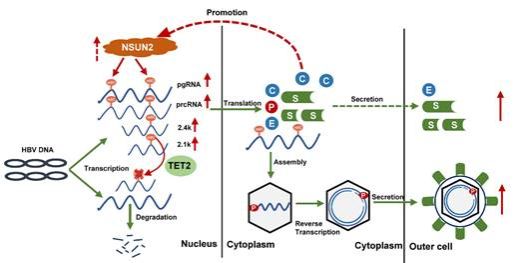
图5 该论文的机制模式图
冯姜澎博士为该论文的第一作者,武汉大学生命科学学院博士研究生徐天墨为该论文的共同第一作者。陈宇教授为该论文的通讯作者,周立副教授为该论文的共同通讯作者。这项工作得到国家重点研发项目、国家自然科学基金等基金的研究资助。
论文信息:
Feng J, Xu T, He M, Li J, Yao P, Ma C, et al. (2023) NSUN2-mediated m5C modification of HBV RNA positively regulates HBV replication. PLoS Pathog 19(12): e1011808.
链接:
https://doi.org/10.1371/journal.ppat.1011808