新型冠状病毒(SARS-CoV-2)是一种正义单链RNA病毒,主要依赖其表面刺突(S)蛋白与宿主细胞受体血管紧张素转换酶2(ACE2)的相互作用侵染细胞。基于这一发现,既往已开发了多种手段来阻止SARS-CoV-2感染,包括中和抗体和基于ACE2的结合肽抑制剂。此外,还成功研发并广泛使用了多种疫苗,在保护人群发面发挥了重要作用。然而,新冠病毒持续变异,导致病毒逃逸免疫监测和疫苗产生的中和抗体。因此,迫切需要研发有效的抗病毒药物,以应对SARS-CoV-2不断出现的变种。
2023年12月6日,哈佛大学医学院魏文毅团队、武汉大学病毒学国家重点实验室蓝柯团队和西奈山医学院金坚团队合作在SCIENCE Translational Medicine在线发表了题为 “USP2 inhibition prevents infection with ACE2-dependent coronaviruses in vitro and is protective against SARS-CoV-2 in mice” 的研究论文。研究发现,USP2是ACE2的去泛素化酶,通过抑制USP2可以降低ACE2蛋白水平,从而阻断SARS-CoV-2对细胞和小鼠的感染。研究结果还表明,通过抑制USP2降低ACE2蛋白水平可以有效抵抗其它多种利用ACE2作为受体进行感染的冠状病毒,表明这是一种广谱的抗病毒策略。研究团队进一步研发了一种可以口服的USP2抑制剂MS102,对ACE2依赖的冠状病毒表现出有效的抗病毒活性。此外,MS102在体内具有良好的药代动力学特性和抗病毒活性,有望进一步发展成为治疗依赖ACE2的病毒感染的抗病毒手段。

将ACE2作为靶点,不仅可以有效应对COVID-19疫情,还可能应对依赖ACE2进行感染的冠状病毒引发的未来疫情。在研究中,团队首先证实了泛素蛋白酶体途径在细胞介导ACE2蛋白降解中起重要作用。 泛素化是一个可逆的过程,去泛素化酶(DUBs)通过从目标蛋白中去除泛素基团,从而增强蛋白稳定性。因此,研究人员建立了一个表达ACE2和荧光素酶融合蛋白(ACE2-Luc)的HepG2细胞系。利用这个细胞系,研究人员通过siRNA介导的基因敲减进行了去泛素化酶(DUBs)的筛选。结果表明,沉默USP2显著降低了ACE2-Luc信号强度(图1)。

图1,USP2是ACE2的生理条件下的去泛素化酶。(A)ACE2去泛素化酶鉴定流程;(B)基于siRNA的去泛素化酶筛选热图。
接下来,研究团队进一步评估了USP2的小分子抑制剂ML364在治疗SARS-CoV-2感染中的治疗潜力,研究人员在Calu-3细胞中感染了SARS-CoV-2原型、Beta、Delta和Omicron/BA.2毒株,感染1小时后,使用PLpro抑制剂(GRL0617),USP2抑制剂(ML364)或GRL0617-ML364联合处理48小时。值得注意的是,ML364对所有经过测试的SARS-CoV-2病毒种类均表现出很好的效果 (图2 A-B)。此外,研究团队使用K18-human ACE2转基因小鼠模型进行了体内测试(图2C)。与细胞培养模型中观察到的结果一致,与对照组相比,在小鼠感染SARS-CoV-2 六小时后给予ML364治疗明显改善了肺部病理变化(图2D)。ML364处理的小鼠肺部和小肠中病毒滴度明显降低(图2E)。此外,研究人员使用两个额外的hACE2转基因小鼠模型(C57BL/6-huACE2和C57BL/6-huACE2-Chimera)对ML364的治疗效果进行了深入研究,发现ML364在这两个小鼠模型中都显示出显著的治疗潜力(图2F)。总的来说,这些实验结果表明通过利用ML364 抑制USP2来降低ACE2蛋白水平在细胞感染模型(体外)和活体动物研究(体内) 都表现出有效抗SARS-CoV-2感染的活性,且不受病毒变异的影响。
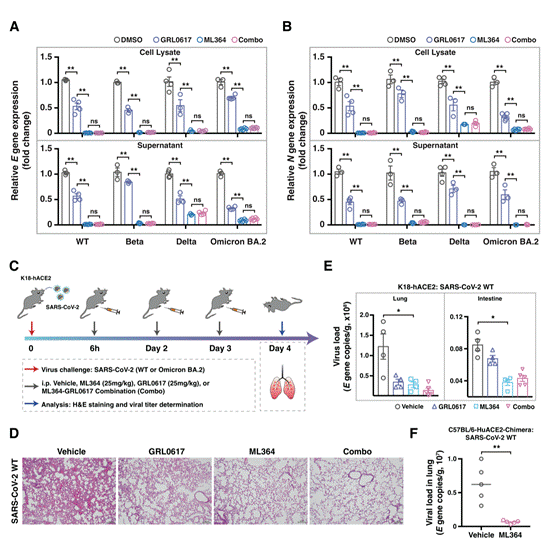
图2,ML364治疗SARS-CoV-2感染的治疗能力。(A-B)在特定的治疗条件下,对SARS-CoV-2原始、Beta、Delta和Omicron/BA.2毒株进行RT-qPCR分析的结果(n=3-6)。在进行治疗之前,Calu-3细胞预先感染了SARS-CoV-2原始、Beta、Delta和Omicron/BA.2毒株,感染浓度为0.1 MOI,感染时间为1小时,然后分别使用DMSO、GRL0617(10μM)、ML364(10μM)和GRL0617-ML364联合治疗48小时;(C)实验流程图,用于研究ML364治疗SARS-CoV-2原始毒株(250 PFU)和Omicron BA.2感染(400 PFU)的治疗潜力;(D)肺组织的HE染色图像;(E)肺组织和肠道组织中的SARS-CoV-2病毒载量(n=4-5);(F)在HuACE2-Chimera小鼠的肺组织中,分别使用溶剂和ML364治疗的SARS-CoV-2病毒载量(n=5)。
虽然ML364显示对ACE2依赖冠状病毒感染的抗病毒潜力,但其现有的药代动力学特性使其无法成为有合适的临床候选药物。因此,研究团队通过全面的化学优化探索了提高其药代动力学特性并保持或增强其抗病毒效力的方法。为了实现这个目标,研究人员设计和合成了大约90个ML364的衍生物。通过分析鉴定出一种特定的化合物,命名为MS102。与ML364相比,MS102具有更好的药代动力学和抗病毒活性,并且有望进一步发展成为口服治疗药物(图3)。
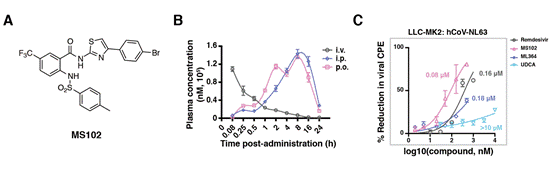
图3,MS102是一种口服USP2抑制剂,具有增强的抗病毒活性。(A)MS102的化学结构;(B)MS102的药代动力学特性; (C) 通过细胞病变效应 (CPE) 实验比较了UDCA、ML364和MS102在治疗hCoV-NL63病毒感染方面的效果。
综上所述,这项研究阐明了USP2去泛素酶在调控ACE2的去泛素化过程中的生理功能,从而在维持其蛋白稳定性方面发挥作用;同时,该研究提供了通过抑制USP2去泛素酶来控制依赖于ACE2冠状病毒感染的可靠证据;此外,研究者成功开发了一种口服可利用的USP2抑制剂MS102。这些发现为治疗依赖于ACE2的病毒感染提供了一种有希望的口服治疗选择。

ML304/MS102抑制ACE2受体功能模式图
哈佛大学医学院讲师党法斌、武汉大学病毒学国家重点实验室副研究员白磊及博士后董家珍、西奈山伊坎医学院博士后胡晓萍等为论文共同第一作者,哈佛大学医学院魏文毅教授、武汉大学病毒学国家重点实验室蓝柯教授和西奈山伊坎医学院金坚教授为共同通讯作者。研究得到了美国国立卫生研究院、中国国家自然科学基金等项目的资助。
论文链接:https://www.science.org/doi/10.1126/scitranslmed.adh7668