2024年12月19日,武汉大学病毒学国家重点实验室徐可教授团队在国际学术期刊Journal of Virology上在线发表了题为 “SARS-CoV-2 S protein disrupts the formation of ISGF3 complex through conserved S2 subunit to antagonize type I interferon response” 的研究论文。研究发现多种感染人的冠状病毒利用外膜蛋白(S蛋白)抑制宿主细胞的干扰素通路,揭示了冠状病毒对抗宿主天然免疫系统的一种通用机制。
在这项研究中,研究人员筛选了新冠病毒编码的19个病毒蛋白,发现S蛋白可显著抑制干扰素下游效应基因元件(ISRE)的活性,野生株新冠病毒以及多种变异毒株,包括阿尔法(Alpha)、贝塔(Beta)、伽马(Gamma)、伊塔(Eta)、卡帕(Kappa)、德尔塔(Delta)、拉姆达(Lambda)和奥密克戎(Omicron)变异毒株的S蛋白均具有抑制干扰素通路的功能。研究人员分析了SARS-CoV-2、MERS-CoV、SARS-CoV、HCoV-NL63、HCoV-229E、HCoV-HKU1等多种感染人的冠状病毒S蛋白,发现在进化上相对保守的S2亚基是冠状病毒抑制干扰素通路的共性结构域。这表明,冠状病毒不仅编码多种病毒蛋白对抗宿主天然免疫系统,更通过保守的病毒序列广泛地破坏宿主细胞的抗病毒免疫(图1)。
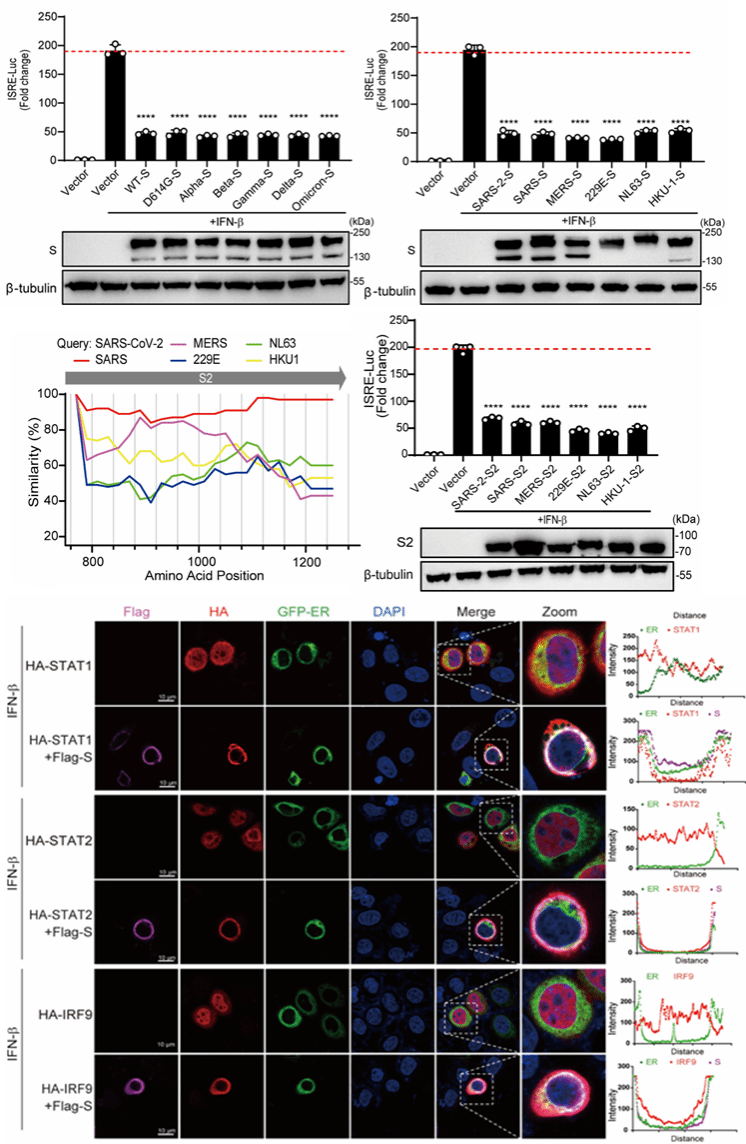
图1. 冠状病毒S蛋白抑制I型干扰素下游信号通路的共性策略
干扰素信号通路通过激活效应细胞的JAK-STAT信号传导途径产生先天免疫应答。该通路上的效应蛋白STAT1、STAT2、IRF9 首先形成三元复合物ISGF3,再进入细胞核,才能激活下游抗病毒基因的表达。机制研究表明,在冠状病毒S蛋白表达的细胞中,ISGF3复合物的所有组分都被禁锢于细胞质中,并与S蛋白发生强烈的共定位现象。这说明,冠状病毒的S蛋白将ISGF3复合物锚定在内质网,导致其丧失了细胞核定位和基因转录功能(图1)。蛋白相互作用实验结果表明,S蛋白通过竞争结合STAT2的CCD结构域,阻止STAT2招募IRF9,从而抑制了ISGF3复合体的形成(图2)。
由于冠状病毒S蛋白也是冠状病毒疫苗的主要抗原,本研究发现的S蛋白抑制天然免疫的分子机制将有助于认识新冠病毒和其他人类冠状病毒逃逸宿主免疫的通用策略(图3),也为优化设计冠状病毒疫苗提供了参考思路。该成果在正式发表前,已于2022年6月6日发表于预印平台bioRxiv(https://www.biorxiv.org/content/10.1101/2022.06.06.494494v1)。武汉大学生命科学学院徐可教授和周立副教授为论文共同通讯作者,武汉大学蔡曾博士、武汉大学生命科学学院博士生倪文佳、硕士生李文康为论文共同第一作者。该研究得到了陈宇教授、蓝柯教授的帮助,以及武汉大学生命科学学院、武汉大学泰康生命医学中心、武汉大学疫苗研究院等平台的支持,研究得到国家自然科学基金、湖北省自然科学基金、中国博士后科学基金的资金资助。
论文链接:https://journals.asm.org/doi/10.1128/jvi.01516-24
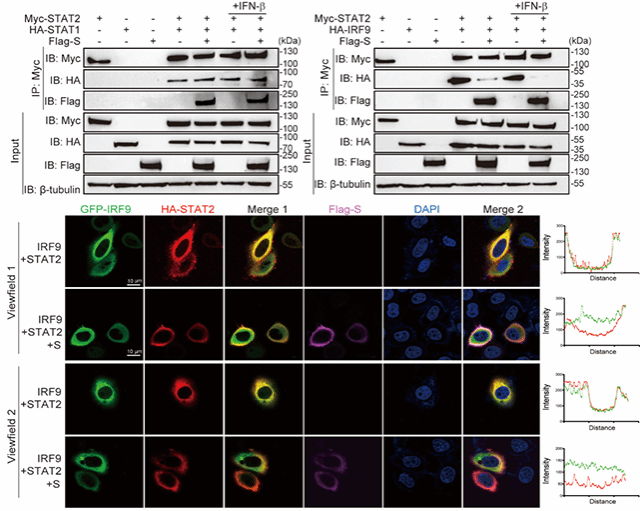
图2. 新冠病毒S蛋白通过竞争结合STAT2抑制ISGF3复合体的形成
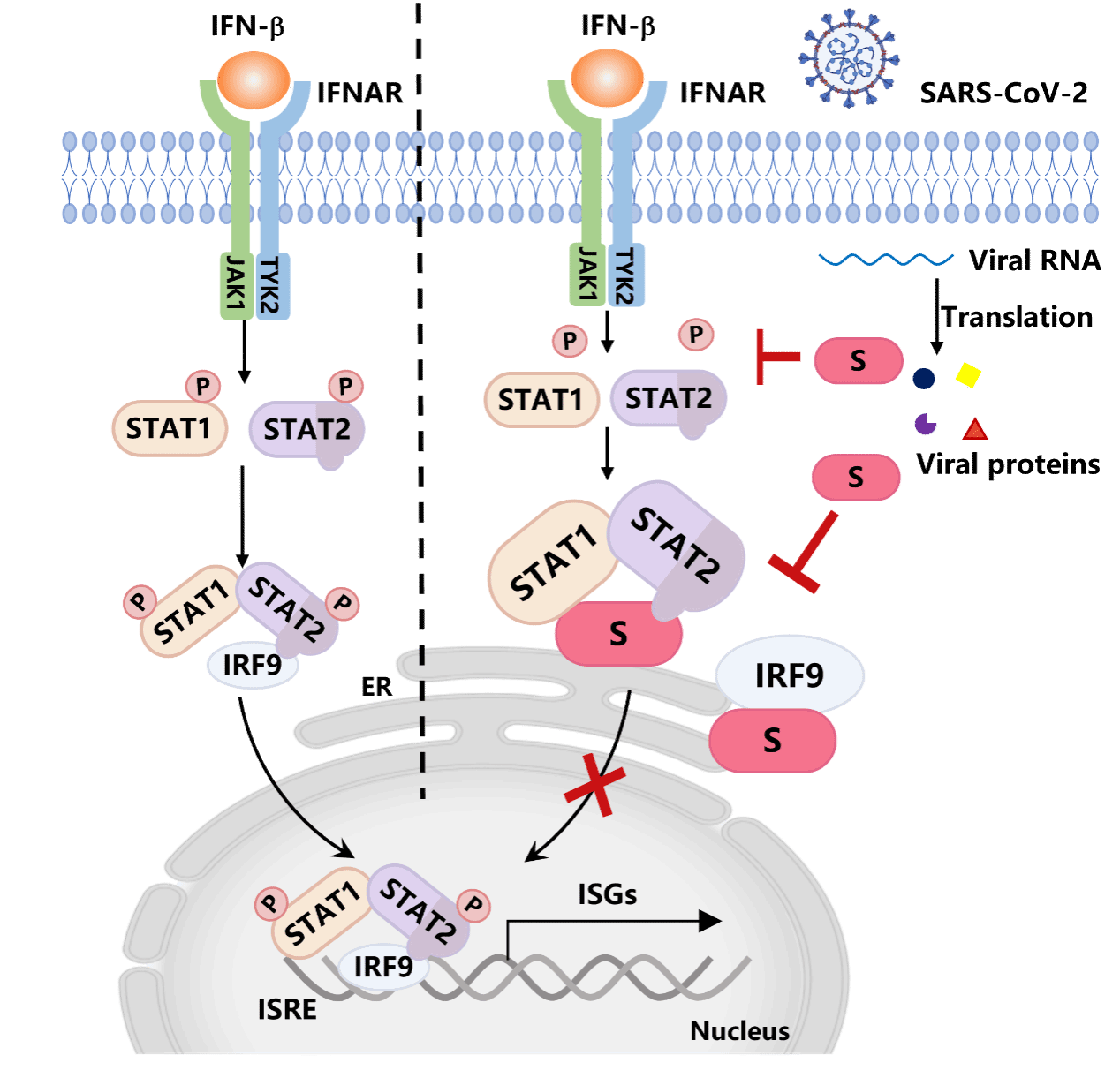
图3. S蛋白抑制I型干扰素诱导的ISGF3复合体形成的示意图。