近日,武汉大学病毒学国家重点实验室陈宇教授研究组在国际学术期刊Journal of Cell Biology在线发表了题为“SARS-CoV-2 specific adaptations in N Protein inhibit NF-κB activation and alter pathogenesis”的研究论文。该研究强调除了冠状病毒刺突蛋白的变异外,其他关键位点的变异同样可能对病毒的致病性产生重要影响,从而改变其传播和感染能力。因此,全面监测和评估这些突变,对于疾病的预防和控制至关重要。

目前已知可感染人类的冠状病毒在流行病学特性上存在显著差异。其中,SARS-CoV和SARS-CoV-2这两种β属冠状病毒的比较尤为典型。与SARS-CoV相比,SARS-CoV-2具有更强的传染性、更长的潜伏期,并且能够通过无症状感染者传播。COVID-19和SARS的临床表现与病毒感染诱发的免疫反应密切相关。尽管两种病毒均能抑制I型干扰素应答并激活炎症反应,但SARS-CoV在炎症反应的激活方面更为显著。此前,该研究团队发现,由于nsp16蛋白中第36、第138和第153位氨基酸的改变,SARS-CoV-2相较于SARS-CoV具有更强的2'-O-甲基转移酶活性。这种增强的活性能够阻止宿主胞浆RNA感应器MDA5和LGP2的识别,从而抑制I型干扰素和促炎细胞因子的表达(Deng et al., Signal Transduct Target Ther, 2024)。在此基础上,团队进一步揭示了SARS-CoV-2和SARS-CoV的N蛋白关键位点的变异如何影响病毒的致病性和传播能力。
该研究基于研究组前期建立的SARS-CoV-2复制子递送颗粒感染模型(Li et al., Virol Sin, 2024),即反向遗传学生成缺失SARS-CoV-2 N基因的复制子递送颗粒(SARS-CoV-2 ΔN-GFP-HiBiT replicon delivery particles,RDPs)感染稳定表达SARS-CoV-2 N和SARS-CoV N蛋白的Caco-2-N*细胞系,系统分析了SARS-CoV-2 N蛋白与SARS-CoV N蛋白对宿主炎症反应的影响。结果表明,相较于SARS-CoV N蛋白,SARS-CoV-2 N蛋白引发的病毒感染过程中宿主细胞的炎症反应较弱(图1)。
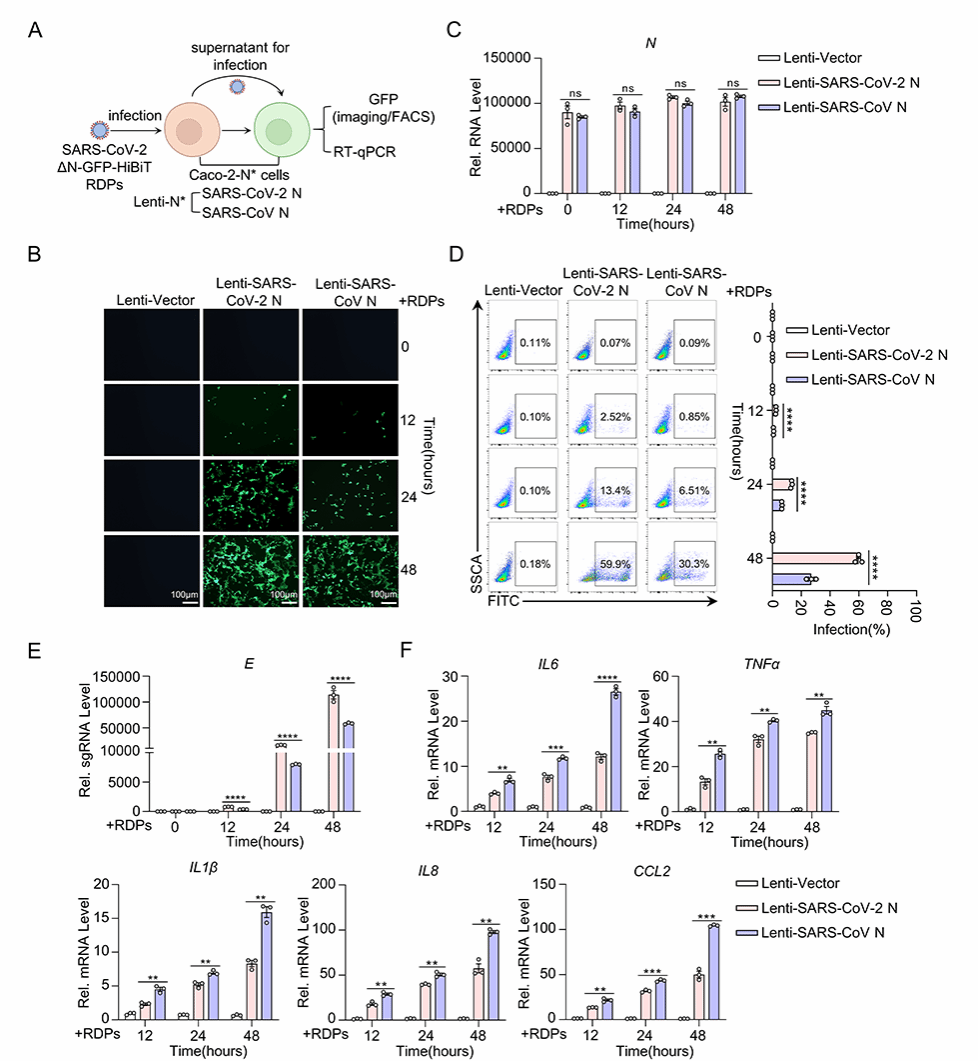
图1. SARS-CoV与SARS-CoV-2 N蛋白调控病毒感染期间细胞炎症的差异
进一步分析发现,SARS-CoV-2 N蛋白通过阻止TAK1-TAB2/3复合物的组装,从而抑制NF-κB通路的激活及其下游信号传导。分子机制研究表明,SARS-CoV-2 N蛋白通过其CTD区域抑制NF-κB通路的激活。与SARS-CoV-2 N蛋白的抑制功能不同,SARS-CoV N蛋白不影响TAK1-TAB2/3复合物的组装,且其N蛋白的CTD区域对NF-κB激活无显著影响。通过比较SARS-CoV-2和SARS-CoV N蛋白CTD区域的氨基酸序列,研究人员发现两者之间存在5个氨基酸的差异。基于此,研究团队构建了SARS-CoV-2 N蛋白5个氨基酸位点的点突变,进一步探索发现E290和Q349是SARS-CoV-2 N蛋白发挥抗炎功能的关键位点(图2)。
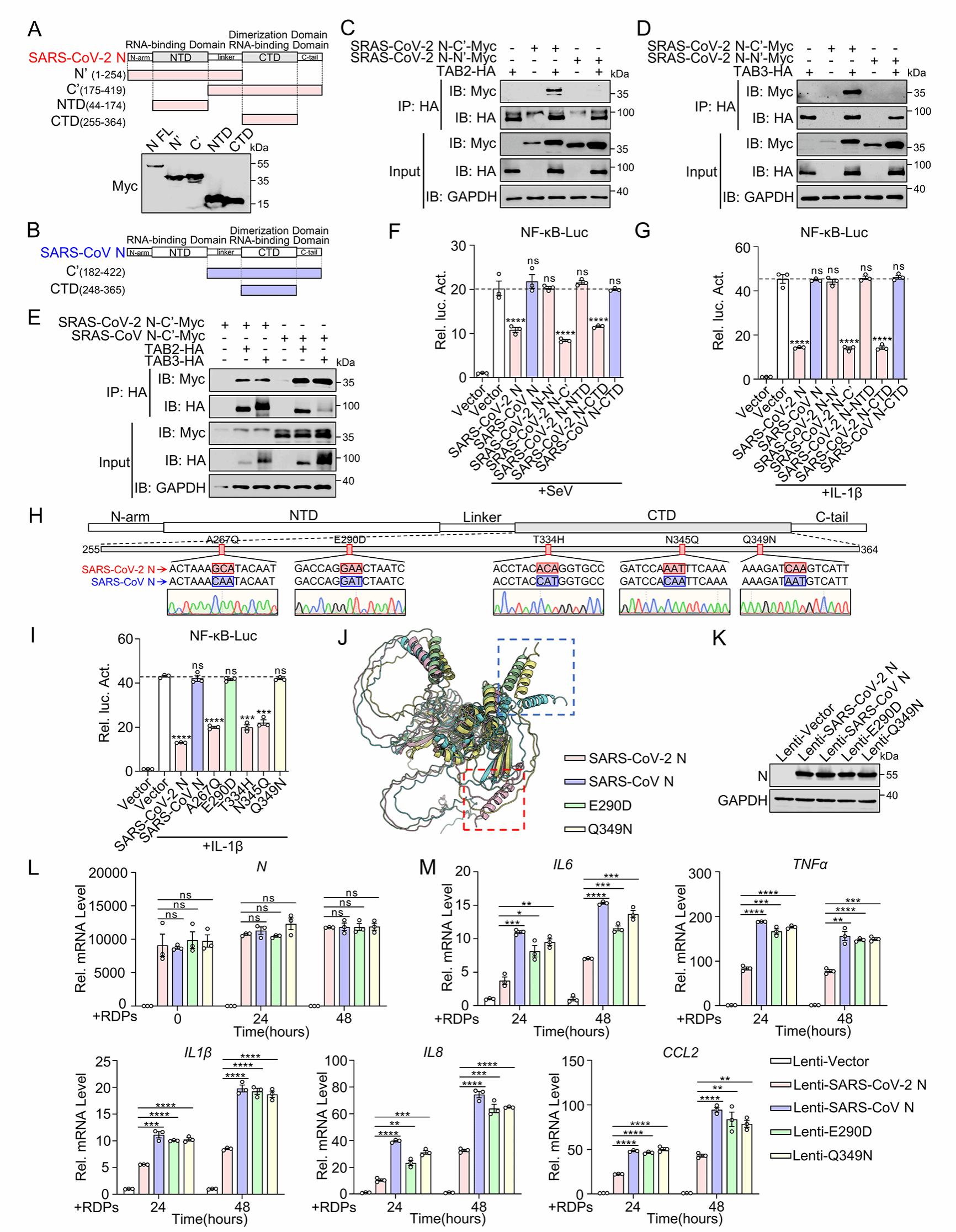
图2. SARS-CoV-2 N蛋白CTD区域的E290和Q349是抑制NF-κB激活的关键位点
研究人员进一步构建了稳定表达SARS-CoV N(WT)、SARS-CoV-2 N(WT)、SARS-CoV-2 N(E290D) 和SARS-CoV-2 N(Q349N)的K18-hACE2 KI小鼠,并建立了RDPs感染模型。结果显示,相较于SARS-CoV,表达SARS-CoV-2野生型N蛋白的小鼠在感染RDPs后,肺部组织炎症较轻。然而,表达突变体SARS-CoV-2 N(E290D)和SARS-CoV-2 N(Q349N)的小鼠在感染RDPs后,肺部组织TNF-α、IL-6等炎症因子的表达水平显著升高,产生与表达SARS-CoV N蛋白的小鼠类似的组织损伤(图3)。小鼠模型进一步证明了SARS-CoV-2 N蛋白的E290、Q349氨基酸位点改变是导致感染SARS-CoV-2后炎症反应严重程度与SARS-CoV不同的关键因素。
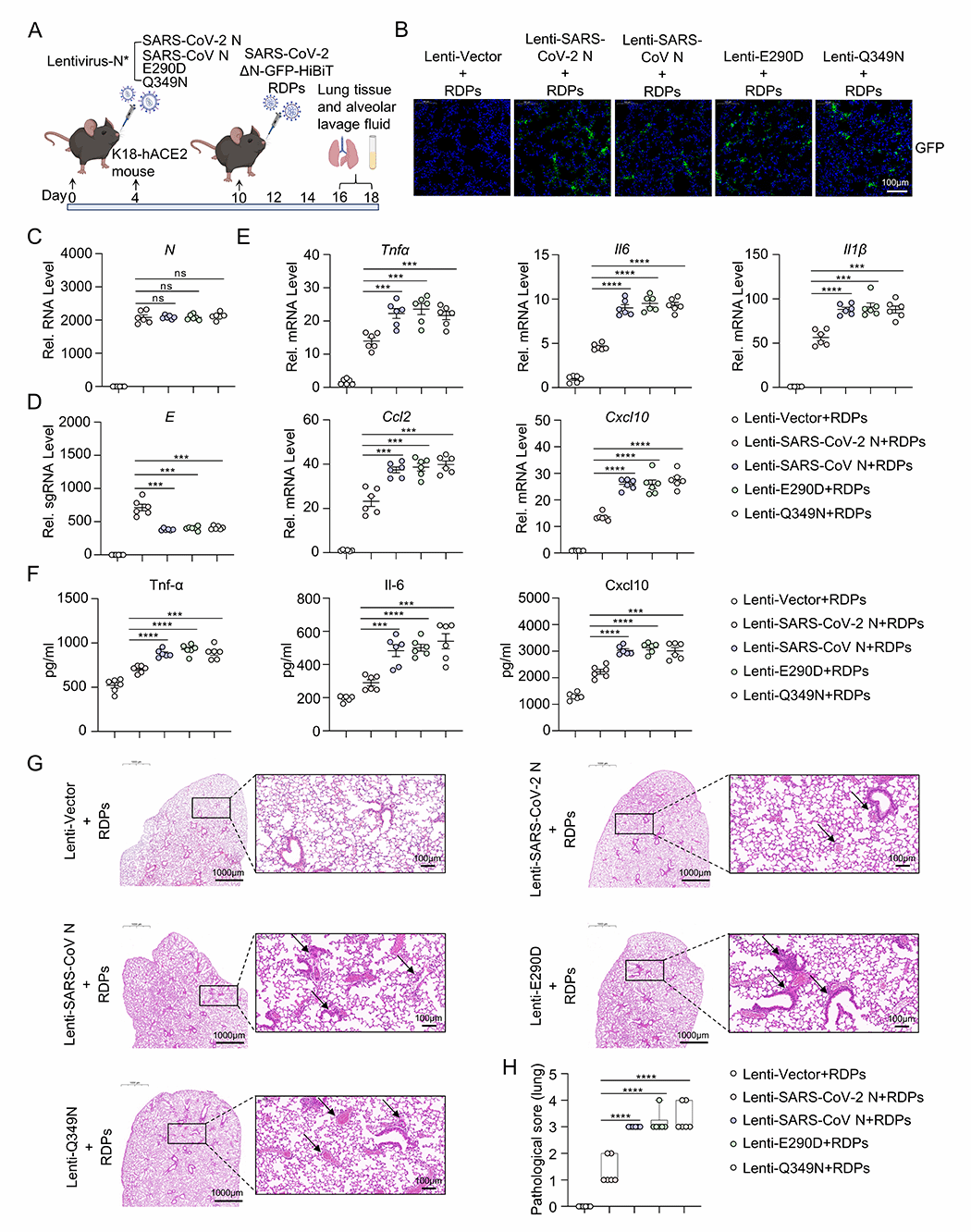
图3. 相较SARS-CoV N蛋白,SARS-CoV-2 N蛋白减轻病毒感染期间小鼠肺部炎症
对SARS-CoV-2野生型、SARS-CoV野生型及Omicron变体(如BA.1、BF.7、BQ.1、XBB.1等)N蛋白的同源性分析显示,SARS-CoV-2野生型与Omicron变体的CTD区域高度保守,无氨基酸替换或插入。而SARS-CoV-2对比SARS-CoV的N蛋白CTD区域存在5个氨基酸位点突变,反映了两种病毒在适应不同宿主和环境中的进化差异。SARS-CoV-2关键位点E290和Q349可能通过抑制炎症和降低致病性,促进了病毒的长期存活并持续传播。该研究鉴定了SARS-CoV-2 N蛋白中抑制NF-κB激活的关键氨基酸位点,揭示了其在病毒致病性和传播中的关键作用,同时为β冠状病毒进化机制的研究提供了重要新线索(图4)。

图4. SARS-CoV-2 N蛋白两个残基的改变触发NF-κB抑制机制
武汉大学病毒学国家重点实验室陈宇教授、周立副教授和徐可教授为该论文的通讯作者,博士研究生郭笑、杨世敏,以及蔡曾博士共同担任第一作者。武汉大学病毒学国家重点实验室主任蓝柯教授,以及郭铭老师和王欣老师为本研究提供了大力支持。本研究得到了国家重点研发计划、国家自然科学基金及中央高校基本科研业务费专项资金等项目的资助。