近日,武汉大学病毒学国家重点实验室陈明周教授团队在病毒调控宿主细胞应激颗粒形成研究方面取得新突破,揭示了小RNA病毒2A蛋白酶通过调控宿主应激颗粒形成逃逸宿主抗病毒反应的新机制。相关研究成果2月7日以“Picornavirus 2A protease regulates stress granule formation to facilitate viral translation”为题在线发表于病原微生物领域病毒学权威期刊PLoS Pathogens上。
研究背景
【应激颗粒(stress granule, SG)是细胞质中大量蛋白和RNA聚集形成的、无包膜的结构。在细胞遇到环境胁迫时,细胞出现应激反应,关闭细胞内mRNA的翻译,导致停止的翻译起始复合物 (translation initiation complexes,PICs) 在胞质内大量的积累,这些失速的PICs聚集并招募一些其他的细胞因子形成SGs,使其免受降解。当环境胁迫消除时,SGs去组装,这些PICs又可以快速的参与翻译。因此,SGs是细胞内调控翻译最为快速、可逆的方式。】
SGs的组装与去组装是细胞内一种调控翻译最为快速、可逆的方式。通常情况下对病毒而言, SGs是一种宿主细胞产生的抗病毒的结构,但大部分病毒会抑制或改造SGs以便利病毒的复制。尽管关于小RNA病毒对SGs的调控机制的研究已进行了十几年,但仍存在较大争议。White等发现在脊髓灰质炎病毒(poliovirus, PV)感染细胞的过程中,在早期可诱导SGs形成,但在中、晚期抑制SGs的形成;其原因是病毒的3C蛋白酶切割了一个SGs形成的关键因子G3BP,导致SGs形成被抑制。但Piotrowska等发现PV感染诱导SGs形成,并且SGs持续稳定的存在于病毒感染的整个生命周期中。而关于小RNA病毒如何诱导SGs的形成,仅有Wu等认为2A蛋白酶可以诱导SG的形成,但并未研究具体机制。
在本研究中,研究者们以小RNA病毒属成员——肠道病毒71型(enterovirus 71, EV71)为例,发现EV71的2A通过切割eIF4GI诱导了以TIA-1、TIAR和Sam68为代表的、持续存在于感染整个生命周期中的非经典SGs(atypical stress granules, aSGs)形成;并且,2A(而非之前所报道的3C)还具有抑制经典SGs (typical stress granules, tSGs)形成的功能。aSGs同tSGs既有相似之处又存在显著的差异。在2A蛋白酶失活重组病毒(EV71-2AC110S)感染的细胞中,aSGs消失,tSGs出现,证实了2A蛋白酶在病毒感染过程中调控SGs的功能。接着,还发现了EV71是通过dsRNAs激活的PKR-eIF2α通路诱导了tSGs的形成,并且在tSGs中非选择性的禁锢了病毒和细胞的mRNAs以抑制病毒的翻译,而在aSGs中只选择性的禁锢了细胞的mRNAs以促进病毒的翻译(图1)。最后,研究者们还发现其他的小RNA病毒(如PV, CVA)的2A蛋白酶也具有诱导aSGs并抑制tSGs的功能。
该研究是首次发现小RNA病毒的2A蛋白酶具有诱导aSGs并抑制tSGs的功能,也是首次证实小RNA病毒通过激活PKR-eIF2α通路诱导tSGs的形成,全面的揭示了小RNA病毒通过2A蛋白酶调控SGs的分子机制和功能,为深入探讨各类病毒与SGs的相互作用机制提供了理论支持。
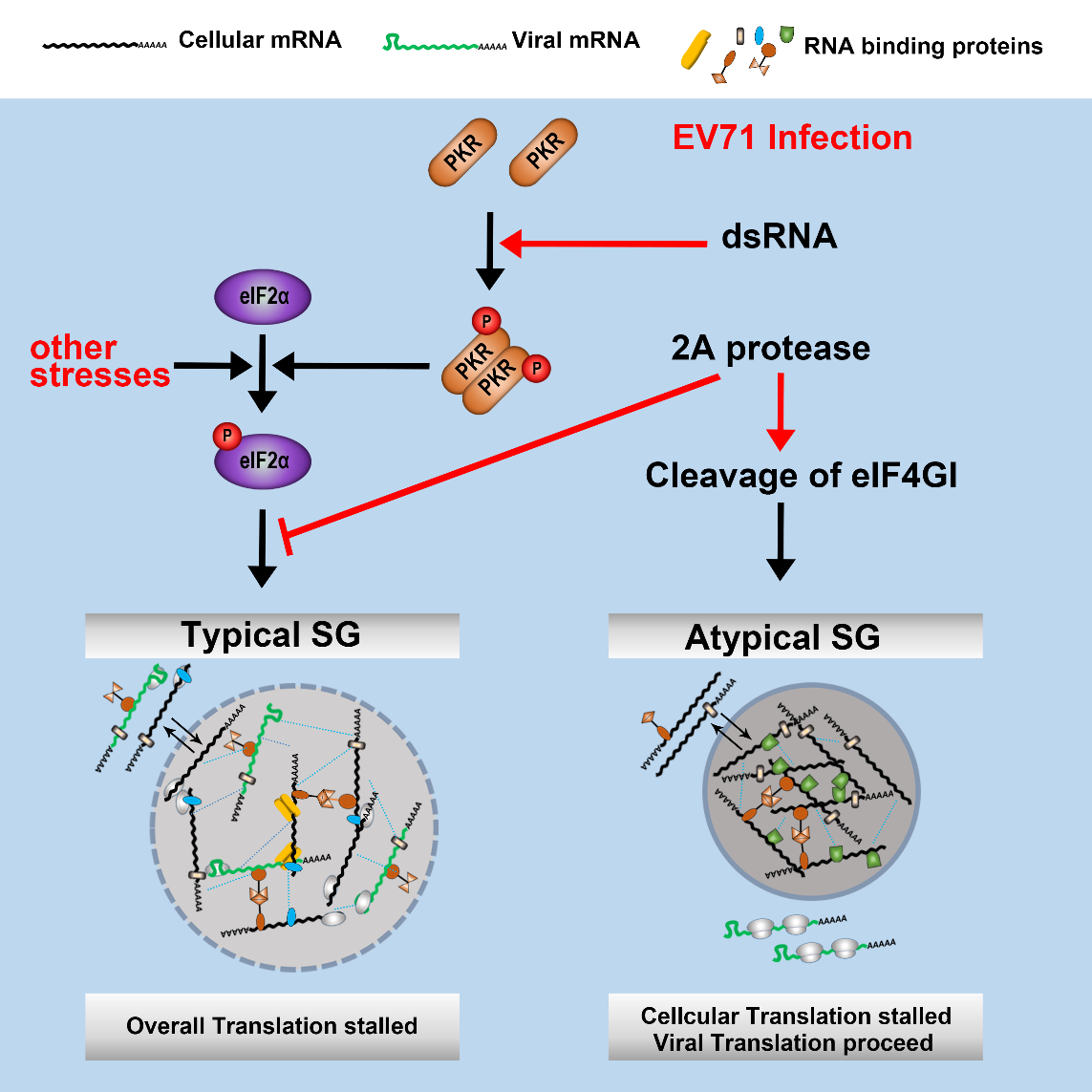
图1. Model of SGs regulation by EV71
本研究获得基金委和科技部项目资助。陈明周教授课题组博士杨小丹为论文第一作者,陈明周教授为通讯作者。后续相关的2A蛋白酶抑制tSGs及aSGs选择性招募宿主细胞mRNAs的机制仍在研究之中。