2019年8月28日,国际学术期刊Science Advances在线发表武汉大学病毒学国家重点实验室蓝柯研究组在解旋酶氧化修饰功能机制研究方面取得的新成果,论文题目为“Viperin Catalyzes Methionine Oxidation to Promote Protein Expressionand Function of Helicases”(Viperin催化解旋酶甲硫氨酸的氧化促进其蛋白稳定及功能)。
卡波氏肉瘤相关疱疹病毒(Kaposi’s sarcoma associated herpesvirus,KSHV)是一种重要的人类肿瘤病毒,具有双链DNA基因组。KSHV感染宿主后能建立终身潜伏感染,病毒基因组利用宿主的复制机器进行复制,并随着细胞的分裂平均地分配到子代细胞中;KSHV在机体缺氧、免疫力低下等病理生理状况下可以被激活进入裂解复制,在这个过程中KSHV利用自身编码的解旋酶(ORF44)、单链结合蛋白(ORF6)等复制机器参与病毒基因组的复制和病毒粒子组装。
该研究以KSHV为研究模型,发现宿主氧化还原酶Viperin (virus inhibitoryprotein, endoplasmic reticulum associated, interferon inducible)和KSHV解旋酶ORF44具有较强的相互作用;进一步研究发现Viperin作为氧化还原酶可以催化ORF44等解旋酶甲硫氨酸的氧化,并通过质谱分析确定了ORF44蛋白的氧化位点。为探索ORF44氧化位点的功能意义,该研究组利用细菌人工染色体(BAC)技术对这些位点进行突变,并重构了数十种具有ORF44不同突变位点的病毒株,最终证明了由Viperin介导的ORF44甲硫氨酸氧化修饰能促进其蛋白的稳定性以及KSHV基因组的复制。
解旋酶广泛参与包括DNA复制、DNA修复以及天然免疫等众多生命过程,具有重要的功能意义。目前领域内对解旋酶的翻译后修饰研究主要集中在泛素化、磷酸化、SUMO化等方面,但对解旋酶其它重要的翻译后修饰及其功能意义知之甚少。为了确定Viperin对KSHV解旋酶的氧化修饰是否具有广谱性,研究组利用宿主DNA复制解旋酶MCM7及RNA解旋酶RIG-I等进行研究,发现Viperin可以和MCM7以及RIG-I等蛋白发生互作,进一步通过质谱分析确定了MCM7和RIG-I蛋白的氧化位点,同时证明了这些甲硫氨酸位点的氧化能促进上述解旋酶的蛋白稳定性及相关功能。
该研究由蓝柯研究组和美国南加州大学冯平辉研究组合作完成,首次确定了氧化还原酶Viperin的蛋白底物,揭示了甲硫氨酸的氧化修饰普遍存在于DNA及RNA解旋酶中并具有重要的功能意义。蓝柯教授和冯平辉教授为论文共同通讯作者,白磊、董家珍等为共同第一作者。该研究得到了国家杰出青年科学基金、国家重点研发计划等项目的资助。
论文链接:
https://advances.sciencemag.org/content/5/8/eaax1031
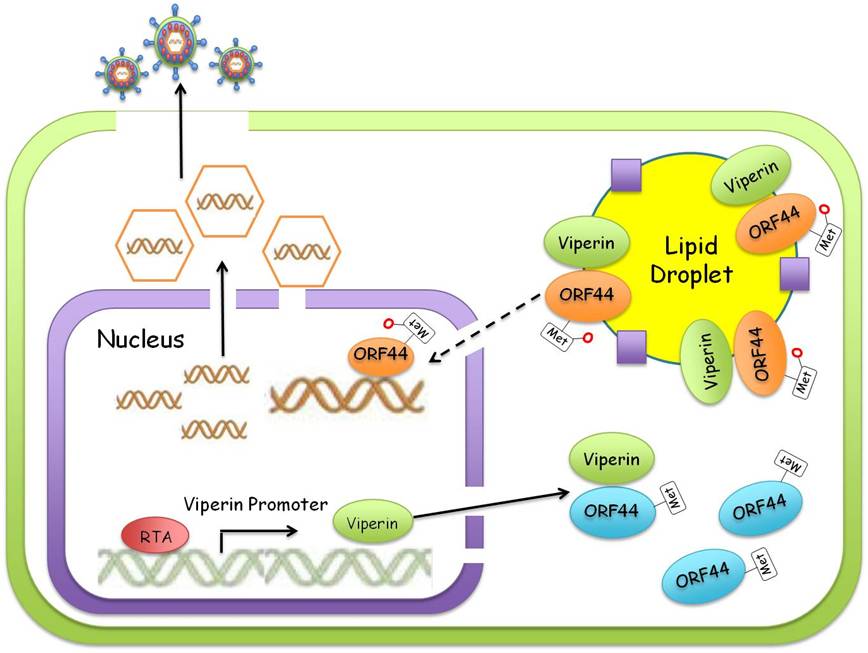
Viperin催化KSHV解旋酶氧化修饰并促进病毒基因组复制