近日,高致病性病毒与生物安全全国重点实验室/武汉大学医学研究院付碧石研究组在国际学术期刊Autophagy上在线发表题为“ATP2A2 regulates STING1/MITA-driven signal transduction including selective autophagy”的研究论文,该研究首次揭示了内质网钙泵ATP2A2与天然免疫核心分子MITA的相互作用网络,发现其调节MITA相关先天免疫的分子机制,并鉴定出其通过网状自噬受体SEC62在MITA介导的选择性自噬中的关键作用。

MITA(亦称STING1)作为胞质DNA感知通路的核心枢纽,既能启动干扰素抗病毒应答,又能通过自噬降解信号分子实现负反馈调节。然而,这种"免疫激活-自噬降解"的双向调控机制始终未获阐明。此次研究中,科研团队发现ATP2A2(ATPase sarcoplasmic/endoplasmic reticulum Ca2+ transporting 2)能与MITA直接相互作用,通过调节MITA的多聚化和转运,调控其介导的先天免疫反应,有效抑制 DNA 病毒感染,这一发现不仅填补了ATP2A2在抗病毒天然免疫领域的研究空白,更为深入理解SERCA家族蛋白的非经典生物学功能开辟了全新方向。
在该文章中,研究团队通过筛选参与MITA介导的选择性自噬的网织自噬受体过程中,确定了SEC62(SEC62 homolog,preprotein translocation factor)为MITA介导内质网自噬的重要受体蛋白。从作用机制来看,在细胞饥饿或MITA激活状态下,SEC62与MITA的结合显著增强,并通过招募自噬标记蛋白MAP1LC3B/LC3B促进自噬体形成,而这些过程均依赖于ATP2A2。该研究不仅首次将SEC62确定为调控MITA介导选择性自噬的新型受体蛋白,而且在MITA介导的内质网自噬中建立了"ATP2A2-MITA-SEC62"信号轴。这一发现为深入探究内质网自噬受体在MITA诱导的选择性自噬过程中的作用机制提供了全新线索,有望为免疫相关疾病的治疗和药物研发带来新的思路与策略。
总的来说,该研究发现ATP2A2是MITA信号通路的关键调控因子。当DNA病毒入侵时,ATP2A2通过促进MITA多聚化并加速其向高尔基体转运,从而增强干扰素信号传导;而在信号过度激活时,ATP2A2通过引导MITA进入自噬降解途径抑制过度免疫反应。
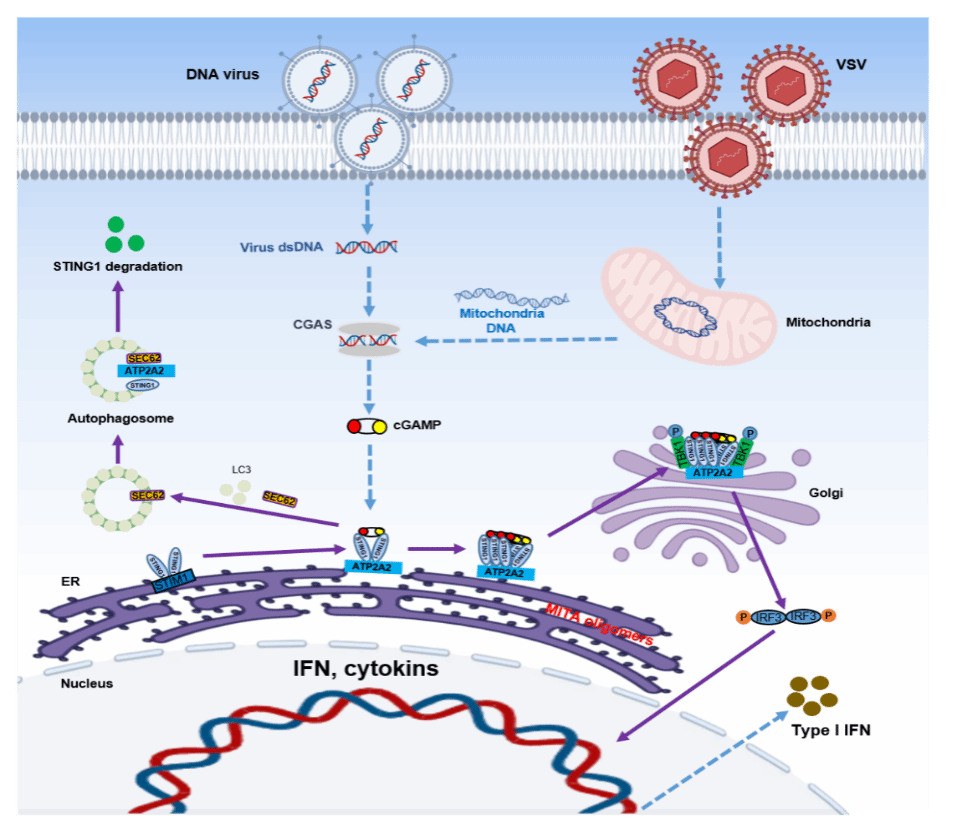
图1. ATP2A2调控MITA介导的天然免疫和选择性自噬的机制
武汉大学医学研究院博士研究生杨雪为论文的第一作者,该研究得到了国家自然科学基金项目、高致病性病毒与生物安全全国重点实验室和湖北省预防兽医学重点实验室开放课题的资助。
原文链接:https://doi.org/10.1080/15548627.2025.2496786