STING(也称为MITA、ERIS和MPYS)是细胞质DNA感受通路中关键的接头分子,在细胞感知胞质DNA引发抗病毒天然免疫反应中发挥着重要作用。此外,cGAS-STING通路在肿瘤免疫及癌症免疫治疗中也发挥关键作用,因此针对STING的激动剂及溶瘤病毒等靶向STING的肿瘤免疫治疗方法进入临床试验或已在临床中使用。以往的研究表明,STING在结直肠癌、黑色素瘤、胃癌等肿瘤细胞中呈现表观沉默或低表达状态,提示细胞内的STING具有抑癌活性,然而STING如何发挥抑癌作用以及是否依赖于其天然免疫活性等尚不清楚。
2023年7月13日,武汉大学病毒学国家重点实验室张军杰教授研究组在国际学术期刊Nature Cell Biology在线发表了题为“STING is a cell-intrinsic metabolic checkpoint restricting aerobic glycolysis by targeting HK2”的研究论文。该研究揭示了天然免疫关键蛋白STING在糖酵解过程中发挥重要的调控作用。
在这项研究中,作者们发现STING的敲除明显促进糖酵解,导致乳酸产生增加。此外,DNA病毒感染或细胞质DNA刺激引发STING降解,同样可以促进糖酵解。代谢组学分析及同位素标记葡萄糖碳流追踪实验也表明STING敲除显著提高糖酵解产物的水平。通过使用各种抑制剂抑制STING降解或回补表达STING均能抑制糖酵解。有趣的是,即使表达丧失天然免疫活性的STING突变体,依然能够抑制糖酵解,表明STING调控糖代谢不依赖于其天然免疫活性。机制研究显示,STING与糖酵解的限速酶己糖激酶HK2结合,并限制HK2的线粒体定位,从而抑制其活性,进而抑制糖酵解过程。作者们进一步鉴定出STING的第二位脯氨酸对于与HK2结合及限制糖酵解至关重要。小鼠实验也验证了这一发现,在小鼠结肠癌肿瘤模型中,STING通过靶向HK2抑制糖酵解促进肿瘤免疫反应,抑制肿瘤生长。此外,在结直肠癌患者样本中,STING的表达水平与肿瘤免疫呈正向关,与乳酸水平呈负相关。该研究不仅揭示了STING不依赖于天然免疫活性调控糖酵解的新功能,也能够解释为何在多种癌细胞中STING呈沉默或低表达状态,同时该发现也为提高靶向STING的肿瘤免疫治疗手段提供了指导。
武汉大学医学研究院/免疫与代谢前沿科学中心博士研究生张丽婷为该论文的第一作者,张军杰教授为通讯作者,武汉大学中南医院江从庆教授、主任医师为并列第一作者,该研究的合作者包括武汉大学医学研究院舒红兵教授、伍兵教授、付碧石教授,武汉大学中南医院李翔教授、魏嵬教授及美国南加州大学Pinghui Feng教授。研究获得国家重点研发计划、国家自然科学基金、武汉大学自主科研项目及病毒学国家重点实验室自主科研项目等资助。
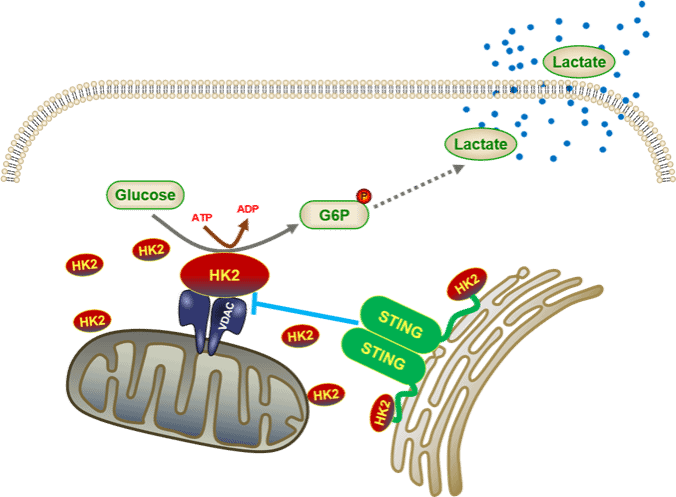
STING靶向HK2抑制糖酵解促进肿瘤免疫反应模式图
论文链接:https://www.nature.com/articles/s41556-023-01185-x