2023年6月15日,武汉大学病毒学国家重点实验室/生命科学学院/泰康生命医学中心严欢课题组在国际学术期刊Cell Discovery上在线发表了题为“Broad host tropism of ACE2-using MERS-related coronaviruses and determinants restricting viral recognition”的研究论文(Article)。

2022年12月,严欢课题组在Nature期刊首次报道NeoCoV和PDF-2180这两种与中东呼吸综合征冠状病毒(MERS-CoV)密切相关的冠状病毒, 使用血管紧张素转换酶2(ACE2)而非DPP4(MERS-CoV受体)作为功能性受体进入宿主细胞。这两种病毒尚不能高效地利用人类ACE2进入细胞,它们在不同哺乳动物中的宿主范围和跨物种传播潜力也尚不清楚。在前期研究的基础上,课题组基于来自49种蝙蝠和53种非蝙蝠哺乳动物的ACE2同源基因,通过受体结合域(RBD)结合实验与假病毒入侵实验,进一步测试了NeoCoV 和 PDF-2180这两种病毒受体使用的偏好性(如示意图1)。基于蝙蝠ACE2的实验结果显示,这两种病毒不能使用绝大多数阴翼手亚目(Yinpterochiropteran)蝙蝠(Yin-bat)的ACE2进入宿主细胞,但可以高效地识别并利用大多数阳翼手亚目(Yangochiropteran)蝙蝠(Yang-bat)的ACE2。这与同样利用ACE2作为功能性受体进入宿主细胞的NL63和SARS-CoV-2表现出不同的受体识别谱。这两种MERS相关冠状病毒在非蝙蝠哺乳动物中均表现出广泛的受体识别谱,其中包括许多和人类关系比较密切的家畜、模式动物、濒危动物以及一些冠状病毒潜在的中间宿主等。
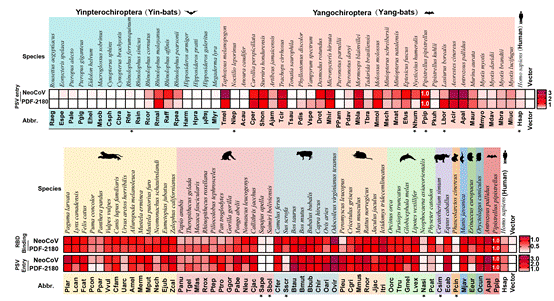
示意图1:NeoCoV和PDF-2180利用蝙蝠(上)和其它哺乳动物(下)ACE2的能力。
为了进一步揭示决定NeoCoV和PDF-2180对来自不同宿主的ACE2受体偏好性的分子机制,团队基于上述ACE2识别效率的数据,对不同蝙蝠以及其它哺乳动物ACE2进行了序列与结构的细致分析,总结出四个关键的宿主范围决定因子A,B, C 和 D(如示意图2)。其中位于关键决定域中的N54 (A) 和N329 (C) 两个位点的糖基化参与了病毒受体相互作用,而E305 (B) 和D338 (D)主要通过盐桥等相互作用在受体识别中发挥了很大的作用。其中宿主决定位点E305 (B)在不同宿主ACE2识别中的重要性尤为突出,特别是对于六种不能被高效识别的非蝙蝠哺乳动物的ACE2。

示意图2:NeoCoV和 PDF-2180不同宿主范围决定位点鉴定
在前期研究中,课题组发现NeoCoV在受体结合基序(RBM)上T510F的突变可以通过增加和人类ACE2(hACE2)的疏水相互作用,实现对hACE2的高效识别。在本研究中,研究人员通过对102个物种的ACE2序列进行保守性分析,发现相互作用界面上存在一个非常保守的疏水口袋。研究结果显示,NeoCoV-T510F突变体假病毒可以通过增强与这一保守的疏水口袋相互作用,进一步扩大宿主识别范围。 (如示意图3)。

示意图3:NeoCoV受体结合结构域T510F突变进一步扩大宿主范围
综上,本研究揭示了NeoCoV和PDF-2180能够广泛地使用不同哺乳动物的ACE2作为功能性受体,并确定了在受体层面限制宿主范围的关键决定因子。该论文为研究使用ACE2受体的MERS-CoV相关冠状病毒识别不同物种ACE2的机制提供了重要信息,突出了深入研究这些潜在高致病性病毒感染、传播与致病机制的必要性,强调了相关病毒的发现、监测与预警对防范未来潜在疫情暴发的重要科学与现实意义。
武汉大学生命科学学院/病毒学国家重点实验室/泰康生命医学中心严欢研究员为论文的通讯作者,生命科学学院2020级硕士研究生马成鲍、2021级硕士研究生刘晨、2022级博士研究生熊清为论文的共同第一作者。清华大学丁强教授以及中国科学院微生物研究所的王奇慧研究员为本研究提供了材料方面的帮助。本研究得到了国家自然科学基金、中央高校基础科研业务费专项基金等经费的资助。
原文链接:https://www.nature.com/articles/s41421-023-00566-8