2023年4月25日 ,病毒学国家重点实验室罗敏华团队在Journal of Virology在线发表了题为 “Human Cytomegalovirus IE1 impairs neuronal migration via downregulating connexin 43” 的研究论文。该研究揭示了人巨细胞病毒(human cytomegalovirus, HCMV)感染导致胎脑发育损伤的新机制。
先天性HCMV感染是导致出生发育缺陷的最重要感染性病因。严重的HCMV感染可导致胎儿脑组织出现无脑回畸形、多个小脑回、小脑发育不全畸形和脑室扩大等脑损伤。这些结构异常通常与孕早期神经发生和神经元迁移异常有关。罗敏华团队近期建立的小鼠巨细胞病毒(MCMV)先天性感染模型,显示感染鼠呈现脑皮层萎缩和神经元迁移异常(JCI insight 2022),但具体分子机制尚未明确。
间隙连接蛋白43(connexin43,Cx43)在未成熟神经元迁移过程中扮演重要角色;Cx43在脑皮层的水平下调会导致神经元迁移受损。本研究首先在HCMV感染的神经前体细胞(neural progenitor cells, NPCs)模型中发现病毒感染通过泛素蛋白酶体途径下调Cx43蛋白水平。进一步的病毒蛋白筛选鉴定出立即早期蛋白IE1介导Cx43下调。对IE1和Cx43的相互作用分析发现Cx43结合在IE1的氨基酸236-250区段;缺失此结合位点IE1则丧失下调Cx43的能力。为了研究IE1下调Cx43产生的生物学效应,通过胚胎电转实现了IE1在小鼠胚胎皮层的异源表达。体内结果不但证实IE1下调胎脑的Cx43,更重要的是发现IE1表达明显抑制了神经元迁移、导致皮层萎缩。通过异源补偿Cx43则可减轻IE1导致的神经迁移损伤;IE1的Cx43结合位点缺失突变体丧失了在体内诱导神经损伤的能力,说明神经元迁移异常是由IE1介导的Cx43下调所导致。
该研究揭示HCMV感染引起神经发育异常的一种新调控机制:HCMV感染通过下调Cx43导致未成熟神经元迁移缺陷,进而影响胎脑发育。为解析HCMV感染诱导先天性脑发育障碍提供了新证据。
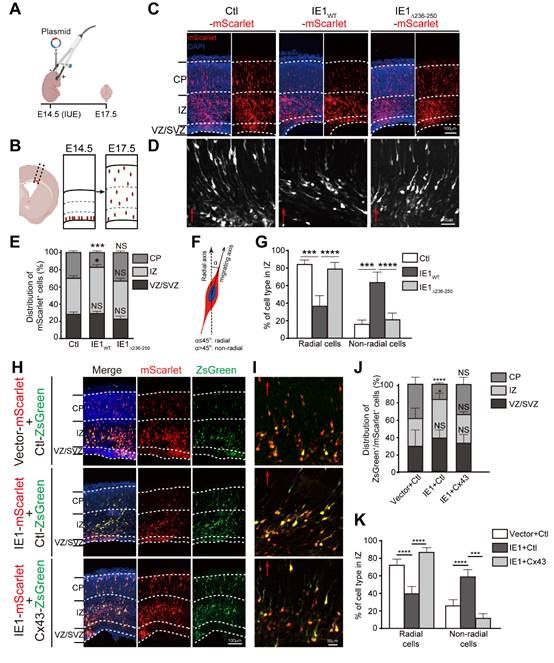
图示:IE1通过下调Cx43影响神经元放射迁移过程
武汉病毒研究所博士生黄胜男为本文第一作者。武汉病毒研究所罗敏华研究员,北京脑科学与类脑研究中心赵非研究员和复旦大学附属上海市公共卫生临床中心程汉副研究员为共同通讯作者。该研究得到国家自然科学基金资助。