近日,武汉大学病毒学国家重点实验室蓝柯/陈宇等在国际学术期刊Cell Insight发表题为“Emerging SARS-CoV-2 variants: why, how, and what’s next?”的封面综述(图1),该文系统地总结了新冠病毒突变体的病毒学特征,并从突变体不断出现的原因、冠状病毒控制突变速度的机制和未来可能出现的突变体的特征等方面进行了探讨,以期加深对冠状病毒突变体的理解。

图1. Cell Insight封面推荐
自2019年底至今,新冠病毒及其突变体累计感染人数已超5亿,导致600多万人死亡(https://covid19.who.int/)。新冠病毒突变体层出不穷,其中有五种突变体在病毒传播的过程中具有重大影响,被列为了受关注的突变体(Variants of concern, VOC):即Alpha,Beta,Gamma,Delta,Omicron。其中Delta和Omicron是目前正在大规模流行的突变体。此外,也有报导Delta和Omicron之间存在重组现象,该重组病毒也称为Deltacron。(图2)
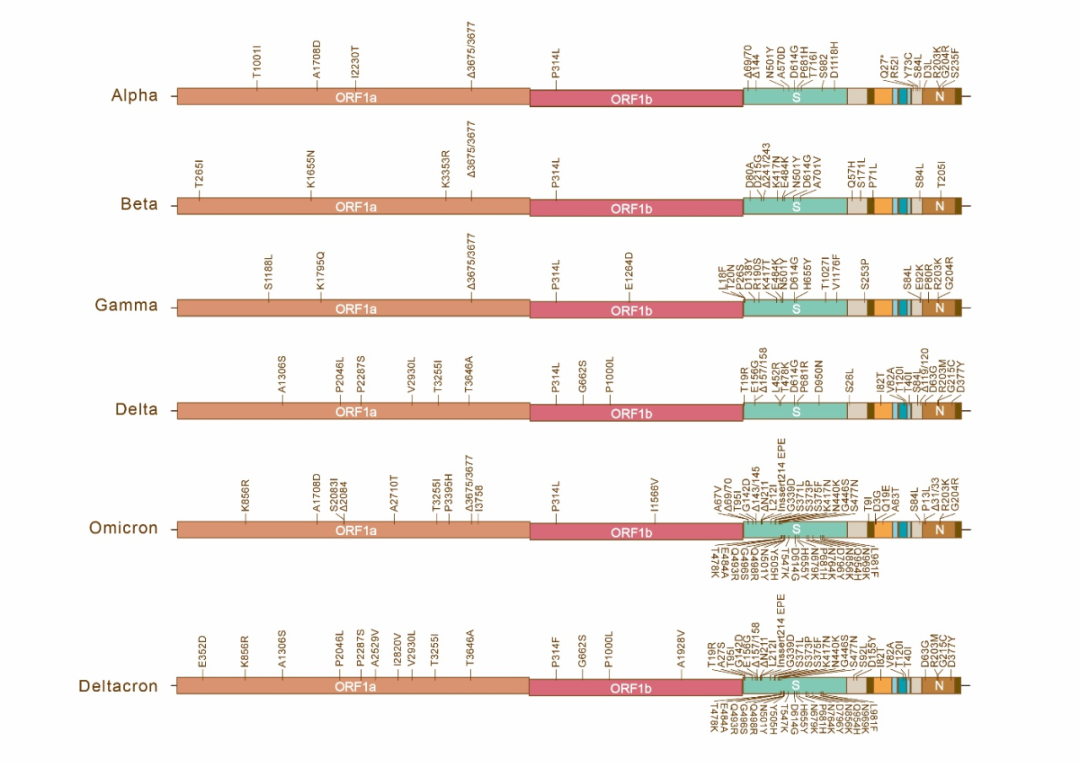
图2. 五种受关注的突变体和Deltacron的基因组结构及其突变位点
该文指出,新冠病毒作为一种RNA病毒,相较于DNA病毒其复制的保真度较差,这也是不同的新冠病毒突变体不断出现的核心原因,且新冠病毒复制过程中突变的发生是不具有序列特异性的。对于新冠病毒突变体的突变位点向结构蛋白,特别是向S蛋白集中的趋势(图2,S蛋白),该文指出,这是由于冠状病毒非结构蛋白(图2,ORF1a/1b)结构与功能保守,非结构蛋白区域发生突变的病毒有较大概率存在复制缺陷,最终被淘汰。而结构蛋白中发生的突变,只要不影响结构蛋白的基本骨架,就有较大的概率得以保留。如果部分结构蛋白上的突变有利于病毒生存,例如S蛋白上的D614G突变可大幅提高病毒的感染效率,该毒株则将迅速占据优势。
同时,对S蛋白上突变位点和S-ACE2复合物结构的分析也可以发现,即使Omicron在S蛋白上存在着大量的突变,野生型(WT),Delta突变体和Omicron突变体的S蛋白与hACE2的相互作用模式依然是保守的(图3)。

图3. S蛋白中部分重要位点及不同突变株S蛋白与hACE2的互作界面
恰当的复制保真率对冠状病毒的生存至关重要,合适的突变率有利于冠状病毒适应不断变化的生存环境,同时也不会因突变率过高而失去基因组的稳定性。冠状病毒通过RNA病毒中独有的一套复制校正机制来调控其复制的保真率(图4)。冠状病毒的非结构蛋白14(nsp14)具有外切核酸酶的活性,这一酶活性在RNA病毒中是十分独特的,可以在RNA复制过程中切除错配的核苷酸,在一定程度上提高了冠状病毒复制的保真率。同时nsp14的外切核酸酶活性还可以被辅助蛋白nsp10调节。冠状病毒通过nsp10/14复合物,将冠状病毒复制的突变率控制在合适的频率,同时也赋予了冠状病毒一定的抵抗核苷类抗病毒药物(如瑞德西韦)的能力。
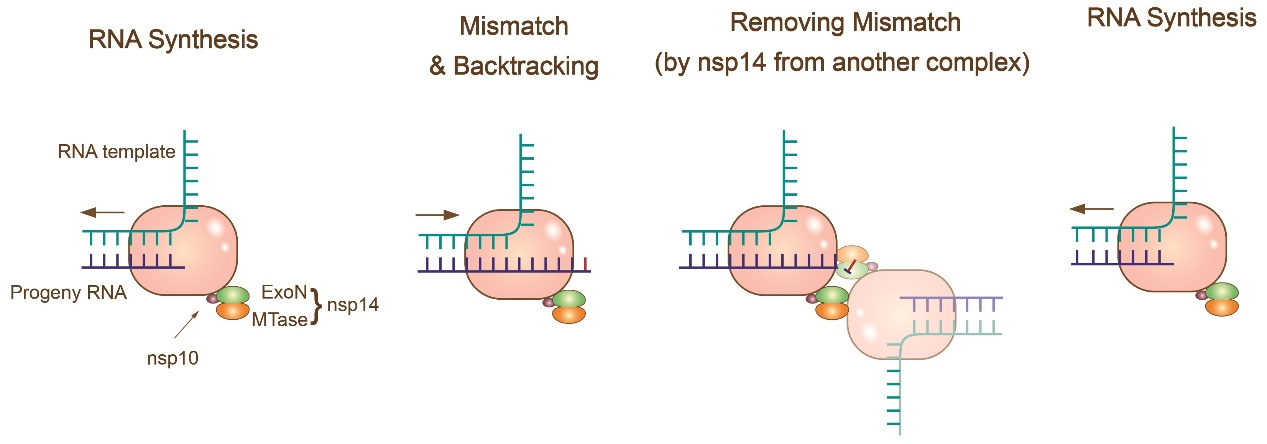
图4. 冠状病毒的回溯校正模型示意图
该文指出,虽然新冠病毒突变株呈现出高传播率、低致病性的进化趋势,但是依然要防范新冠病毒的跨物种传播。同时在使用针对冠状病毒药物的过程中也应注意避免出现耐药性。开发广谱高效的新冠病毒疫苗、开发广谱抗冠状病毒药物、提高疫苗接种率,是人类在与冠状病毒博弈的过程中占据优势地位的前提。
蓝柯教授、陈宇教授为该文共同通讯作者,刘乾运博士为论文共同第一作者。该工作得到了武汉大学新冠科技攻关专项基金、北京泰康溢彩公益基金会及国家自然科学基金等的资助。
论文链接:https://www.sciencedirect.com/science/article/pii/S2772892722000268