近日,武汉大学病毒学国家重点实验室陈宇教授课题组在国际学术期刊Science Advances在线发表了题为“Epitranscriptomic m5C methylation of SARS-CoV-2 RNA regulates viral replication and the virulence of progeny viruses in the new infection”的研究论文。该研究揭示了RNA甲基转移酶NSUN2通过介导新冠病毒RNA的m5C甲基化修饰来调控病毒复制,同时可将这种表观转录组学修饰遗传给子代病毒,在新一轮感染中影响子代病毒的复制能力和致病力。
目前已经发现了超过170种不同类型的RNA化学修饰。5-甲基胞嘧啶(m5C)尤为显著且广泛存在于各种类型的RNA上,参与调节RNA代谢及功能。本研究通过结合LC-MS/MS,m5C-MeRIP-seq以及RNA-Bis-seq等多种技术,鉴定了m5C甲基转移酶NSUN2特异性介导的新冠病毒RNA上的m5C甲基化修饰水平、位点及分布(图1)。NSUN2介导了新冠病毒RNA上多个区域上的m5C甲基化修饰,而这些区域RNA的m5C甲基化修饰显著促进了它们的降解速率,从而抑制新冠病毒在机体内的复制水平。而将这些甲基化修饰位点突变后,相应转录产物的表达水平和稳定性会升高。在多种不同的新冠病毒感染细胞模型和小鼠模型上,NSUN2的缺失会特异性增强病毒复制水平及致病力。
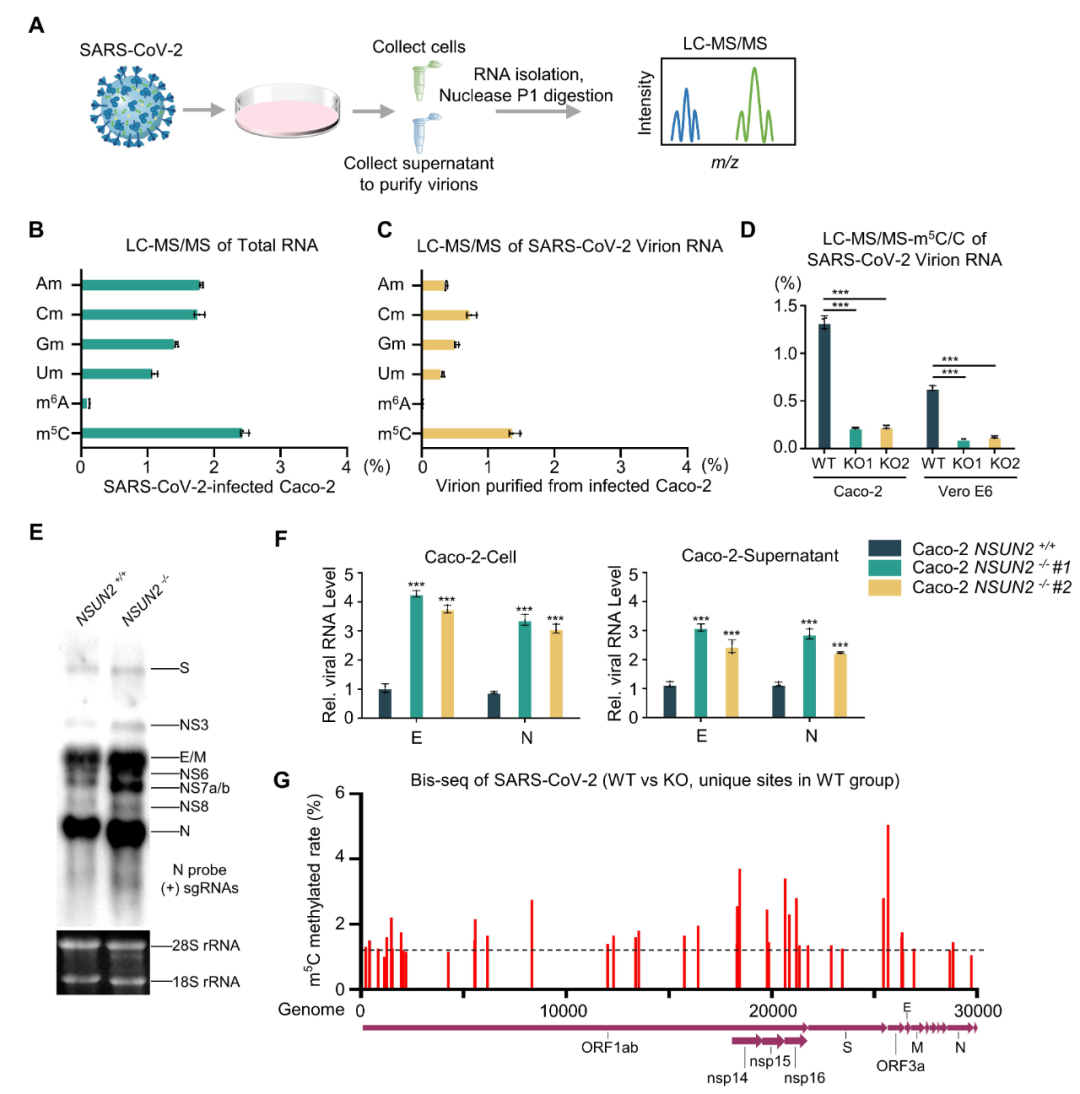
图1. NSUN2介导新冠病毒RNA的m5C甲基化修饰调控病毒复制
由于新冠病毒RNA上存在较多的修饰位点,本研究进一步从整体上探究NSUN2介导新冠病毒RNA的m5C甲基化修饰对病毒复制和子代病毒毒力的影响。研究人员通过利用新冠病毒安全型复制子系统(具有转录和复制能力的病毒样颗粒,trVLP)分别扩增和收集了含有不同m5C修饰水平的子代病毒颗粒。将含有正常水平m5C修饰的新冠病毒样颗粒(trVLP with normal m5C)和低水平m5C修饰的新冠病毒样颗粒(trVLP with low m5C)以相同的MOI再次感染细胞后,低水平m5C修饰的新冠病毒样颗粒(trVLP with low m5C)呈现出更强的复制能力(图2)。
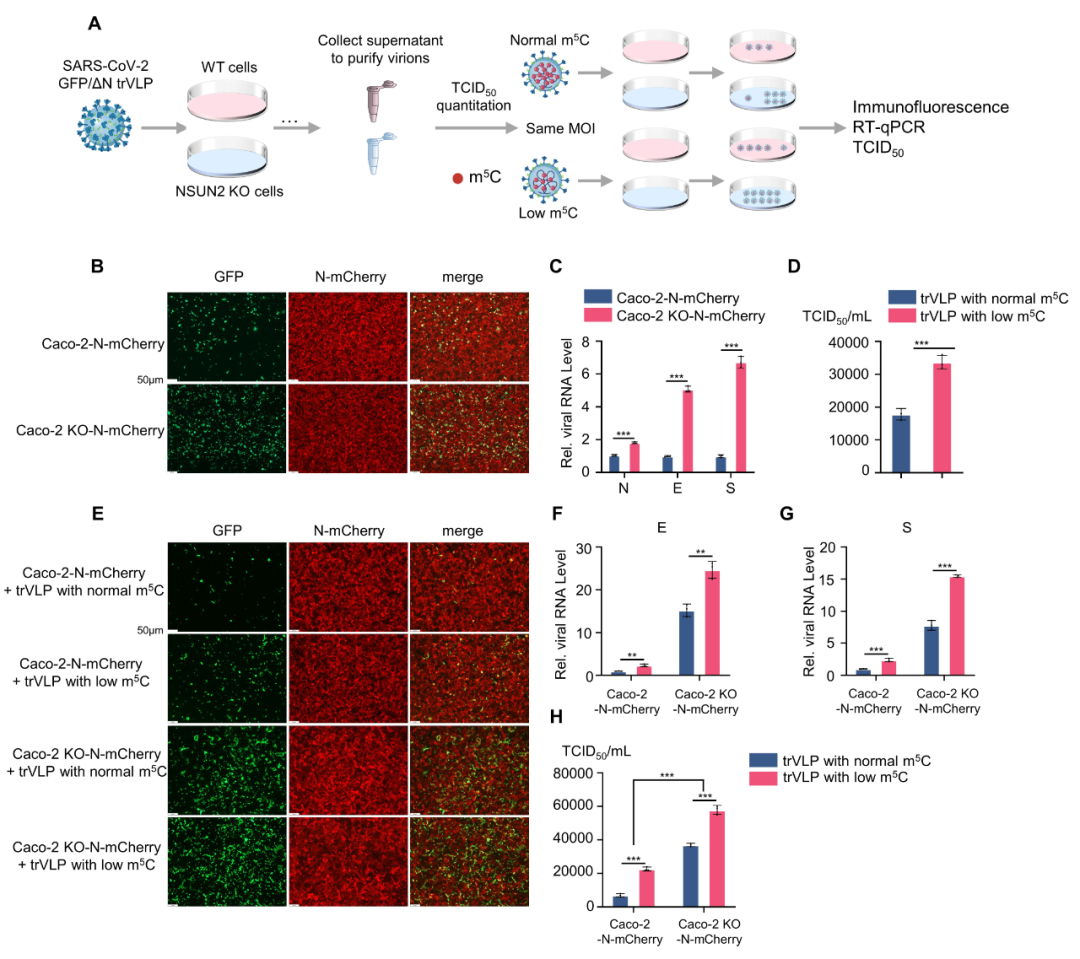
图2. 含有低水平m5C修饰的新冠病毒样颗粒呈现出更强的复制能力
进一步研究发现在新冠病毒感染期间,细胞、小鼠以及新冠病人体内NSUN2的表达水平均会显著降低(图3)。而在病毒被逐渐清除后,NSUN2的表达会逐步恢复到正常水平。NSUN2在重症患者中的表达水平低于轻症患者。相应地,重症患者体内病毒和宿主RNA上的m5C修饰减少。研究人员巧妙地通过使用小鼠模型实验模拟重症和轻症患者,研究发现NSUN2缺陷型小鼠(低m5C水平,模拟重症患者)产生的子代病毒在K18-hACE2小鼠模型的新一轮感染中比来自正常小鼠(正常m5C水平,模拟轻症患者)的子代病毒具有更强的复制能力和致病力(图3和图4)。上述结果提示新冠重症患者体内产生的子代病毒由于缺乏m5C甲基化修饰,在新一轮感染中可能具有更强的复制能力和致病力。
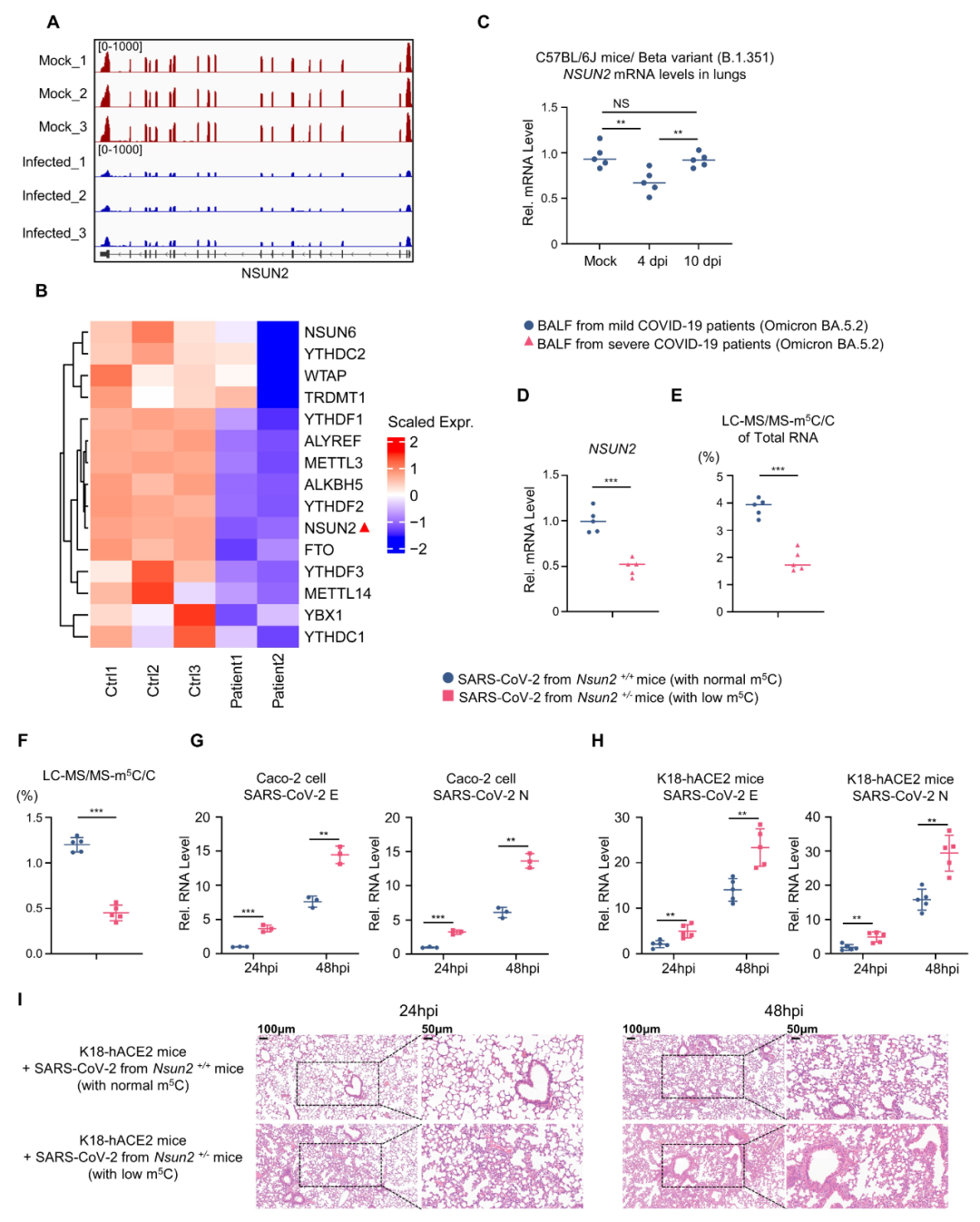
图3. 含有低水平m5C的新冠活病毒颗粒呈现出更强的复制能力和致病力
图4. NSUN2介导的m5C修饰在新一轮感染中调控子代病毒毒力
总的来说,该研究揭示了NSUN2介导的m5C甲基化修饰在调控新冠病毒复制和子代病毒毒力中的重要作用,并提出了一种通过将m5C甲基化修饰添加到病毒RNA上的机体抗病毒策略,这将有助于开发新型抗冠状病毒药物或有效的治疗干预措施。
武汉大学病毒学国家重点实验室陈宇教授为该论文的通讯作者,博士后王虹运为该论文的第一作者,生命科学学院已毕业博士冯姜澎为该论文的共同第一作者。蓝柯教授、周立副教授等给予了该研究大力支持。该研究得到了国家重点研发计划、国家自然科学基金、中央高校基本科研业务费和中国博士后科学基金等项目资助。