近日,国际学术期刊Journal of Medical Virology在线发表了病毒学国家重点实验室罗敏华团队的最新研究成果,论文题为“Human cytomegalovirus infection perturbs neural progenitor cell fate via the expression of viral microRNAs”(人巨细胞病毒通过表达病毒小核糖核酸干扰神经前体细胞命运)。该工作为揭示人巨细胞病毒(Human Cytomegalovirus,HCMV)感染导致胎脑损伤机制提供了新依据。
神经前体/干细胞(neural progenitor/stem cell,NPC)是神经发育的基础,也是胎脑中对先天性HCMV感染最敏感的靶细胞。HCMV感染抑制NPCs细胞增殖,并诱导NPCs异常分化,导致NPCs细胞命运改变的机制仍未透彻解析。小核糖核酸(miRNAs)是真核生物中广泛存在的21至23个核苷酸的非编码RNAs,通过结合mRNA 的3’UTR调控靶标基因表达。HCMV可编码至少26种miRNAs,但在NPCs中的表达谱与是否参与NPC细胞命运调控未见报道。
罗敏华团队基于HCMV感染人NPCs细胞模型,通过miRNAs微阵列分析发现大多数宿主 miRNAs水平未受影响,而6种病毒miRNAs水平显著升高。继续经深度学习的计算生物学分析策略对病毒miRNAs与相应mRNA转录组学数据进行了整合分析,预测出病毒miRNAs的调控网络,并对特定靶标进行验证。发现病毒 miRNAs的调控靶标显著富集于神经发育和细胞周期等通路;经qRT-PCR验证了病毒miRNAs和调控靶标基因的表达水平;通过构建hcmv-miR-US25-1缺陷病毒和靶标Jag1的3’UTR突变体,证实了hcmv-miR-US25-1与神经发生关键分子之一的Jag1 3’UTR靶位点的结合,并导致NPCs中Jag1 mRNA 和蛋白质水平均显著降低。该研究通过运用深度学习、多组学整合等计算生物学、生物信息学方法指导实验设计,系统性的研究了HCMV miRNAs在感染过程中的表达情况及其对神经发育相关宿主基因表达的影响,为进一步探讨先天性HCMV感染致胎脑畸形机制提供系新思路。
武汉病毒所-广州市妇女儿童医疗中心联合博士后姜旋、奥斯陆大学刘思情和病毒所博士毕业生付亚茹为共同第一作者;武汉病毒研究所罗敏华研究员、奥斯陆大学Simon Rayner教授为共同通讯作者。该研究得到了国家自然科学基金和挪威研究委员会的资助。
论文链接: http://dx.doi.org/10.1002/jmv.28574
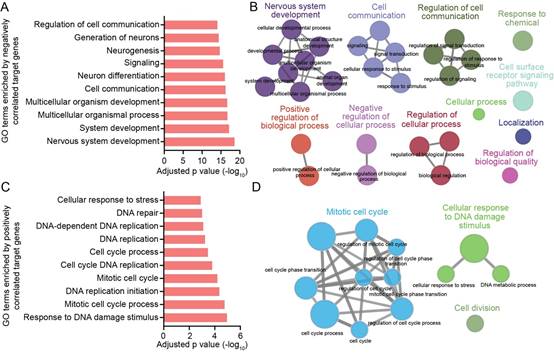
图示:HCMV感染NPCs通过表达病毒miRNAs影响神经发育及细胞周期的靶标基因。