近日, 国际学术期刊ACS Catalysis(《ACS催化》)在线发表了病毒学国家重点实验室门冬课题组与中国科学院生物物理研究所张先恩课题组联合团队的最新研究成果。论文题为“Self-assembled enzymatic nanowires with a ’dry and wet’ interface improve the catalytic performance of Januvia transaminase in organic solvent”。该研究开发了一种具有独特“干湿”界面(疏水-亲水杂合界面)的自组装酶纳米线,可以有效提升转氨酶等在有机溶剂中的催化性能。
酶促催化被认为是化学工业的主要驱动力之一,酶分子具有多种理想的性质,应用范围很广,从合成医药中间体到大规模利用可再生资源生产生物燃料。然而,很多药物前体作为反应底物并不能在水中溶解,需要在有机溶剂中进行反应。虽然在有机溶剂中进行酶促催化反应有多种优点,但有机溶剂通常会导致酶分子变性,从而影响其催化性能。因此,提高酶分子在有机溶剂中的稳定性是改善酶有机相催化性能的关键。
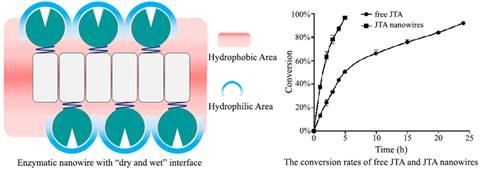
针对上述问题,本研究利用酵母朊蛋白Sup35能够自组装形成线状纳米结构的性质,将西他列汀(糖尿病治疗药物)合成的关键酶Januvia转氨酶(JTA)与Sup35自组装结构域相融合。通过Sup35的自组装,JTA展示在Sup35纳米线的表面形成了JTA纳米线。酶分子与纳米线相互作用形成了同时具有亲水与疏水两种性质的“干湿”杂合界面,该界面一方面通过表面的疏水微环境富集疏水性的底物分子,另一方面通过表面的亲水部分保护了JTA在有机溶剂中的稳定性,从而提高了JTA在有机溶剂中的催化性能。所得到的JTA纳米线催化活性((33.610±2.406)×10-3s-1)相对于游离JTA((7.088±0.351)×10-3s-1)提高了4.7倍以上,90%转化率所需时间由游离JTA的24h缩短到4.5h以下。JTA纳米线显示出比游离JTA显示更好的热稳定性和pH稳定性,以及更好的有机溶剂适应性。这种自组装策略为提高酶在有机溶剂中的性能提供了极具应用前景的技术路线。
武汉病毒所/病毒学国家重点实验室博士生魏翠华为论文第一作者,武汉病毒所/病毒学国家重点实验室门冬研究员和生物物理所张先恩研究员为论文共同通讯作者。本研究得到了国家自然科学基金、国家重点研发计划、中国科学院战略重点研究计划、中科院青促会等项目资助。
文章链接:https://pubs.acs.org/doi/10.1021/acscatal.1c04293