近日,病毒学国家重点实验室刘昱教授课题组在国际学术期刊Cell Reports上在线发表了最新研究成果,论文题为“TMED2 potentiates cellular IFN responses toDNA viruses by reinforcing MITA dimerization and facilitating its trafficking”,原文网址:https://www.cell.com/cell-reports/fulltext/S2211-1247(18)31811-4。
DNA病毒感染宿主细胞后,细胞质内模式识别受体cGAS识别病毒DNA后催化胞质内ATP和GTP合成cGAMP。cGAMP作为胞内第二信使活化位于内质网(ER)上的接头蛋白MITA(又称为STING)。活化后的MITA增强自身二聚体形成,从ER经由高尔基体转运到核周小泡,并招募激酶TBK1和IKKe,形成MITA信号复合体。TBK1不仅磷酸化MITA,导致MITA进一步泛素化,也可磷酸化活化招募到复合体中的转录因子IRF3。磷酸化的IRF3二聚化并转位到细胞核内,启动I型干扰素转录。MITA信号转导复合物的组装也诱导了NF-kB的激活,启动相关炎症因子和趋化因子的产生。IFN效应和炎症反应不仅作为机体天然免疫反应帮助机体抵御病毒入侵,也促进了适应性免疫的产生。由于MITA在抗DNA病毒信号通路中的重要作用,其表达和活化的调控机制一直是研究热点。
该研究利用双荧光素酶报告基因实验系统对人源cDNA文库进行了功能性筛选,获得了能明显协同cGAS-MITA激活ISRE启动子的分子TMED2。研究人员发现敲低或敲除TMED2明显抑制HSV-1感染诱导的MITA二聚化以及转录因子IRF3和NF-kB的活化,降低I型干扰素和炎症因子的相关基因转录;在TMED2敲除的细胞中HSV-1复制也明显增加,表明TMED2促进抗DNA病毒天然免疫信号通路。进一步的研究发现HSV-1感染诱导内源性TMED2与MITA在ER腔内发生相互作用。TMED2通过增强MITA与转位复合体关键成分TRAPb的相互作用,促进MITA翻译后从核糖体向ER转位;TMED2也通过强化MITA与COPII复合物成分Sec24C的相互作用,促进MITA经COPII复合物组装,由ER向高尔基体转运。该论文发现了MITA信号通路的新调控分子TMED2,并解析了其作用机制,为构建天然免疫信号转导调控网络提供重要支持,也为筛选抗病毒药物的分子靶点提供线索。
博士研究生孙明顺为本文第一作者。该研究得到国家自然科学基金(31770941,31521091)、国家重大基础研究计划(2014CB910103)、武汉大学自主科研基金(2042018kf0241)等项目资助。
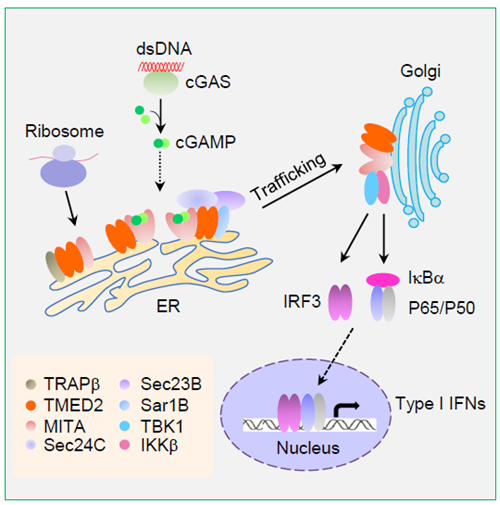
图示:TMED2调控MITA作用机制的示意图