1月4日,国际学术期刊Nature Communications在线发表了病毒学国家重点实验室刘实研究组的最新研究成果,论文题为“Hepatitis B virus rigs the cellular metabolome to avoid innate immune recognition”。该研究工作揭示了在HBV感染过程中,HBV通过促进葡萄糖糖酵解作用产生乳酸,减弱RIG-I样受体(RLR)-线粒体抗病毒信号蛋白MAVS信号传导,实现免疫逃逸的新机制。
RIG-1样受体(RLRs)是胞质RNA传感器,其通过线粒体抗病毒信号蛋白VISA(也称为Cardif,MAVS和IPS-1)发出信号。MAVS募集并激活TBK1激酶,其进一步磷酸化和激活转录因子IRF3,诱导I型IFN的表达。这项工作发现,HBV感染的早期,会促进信号蛋白Akt与己糖激酶2(HK2)结合并通过磷酸化使之活化,活化的HK2通过与电压依赖性阴离子通道VDAC1和MAVS结合,在线粒体上形成三元复合物。该三元复合物的形成竞争性的影响MAVS与RIG-I结合,进而抑制I型IFN的表达。进一步的研究表明,HBV感染促进糖酵解,诱导乳酸酶将丙酮酸还原转化为乳酸。乳酸直接与MAVS结合,导致MAVS的线粒体定位变化,削弱了MAVS在HBV感染期间聚集,影响RIG-I和MAVS的结合,最终抑制I型IFN的表达。因此,该研究发现HBV感染期间能量代谢对先天免疫的调节的现象,明确了HK2和糖酵解来源的乳酸在HBV的免疫逃逸中具有重要功能。
刘实副教授为通讯作者。该工作获得了国家自然科学基金等学基金(81872262, 31570870, 81301428),中央高校基本科研业务费专项资金(2042017kf0221, 2042015kf0188)的研究资助。
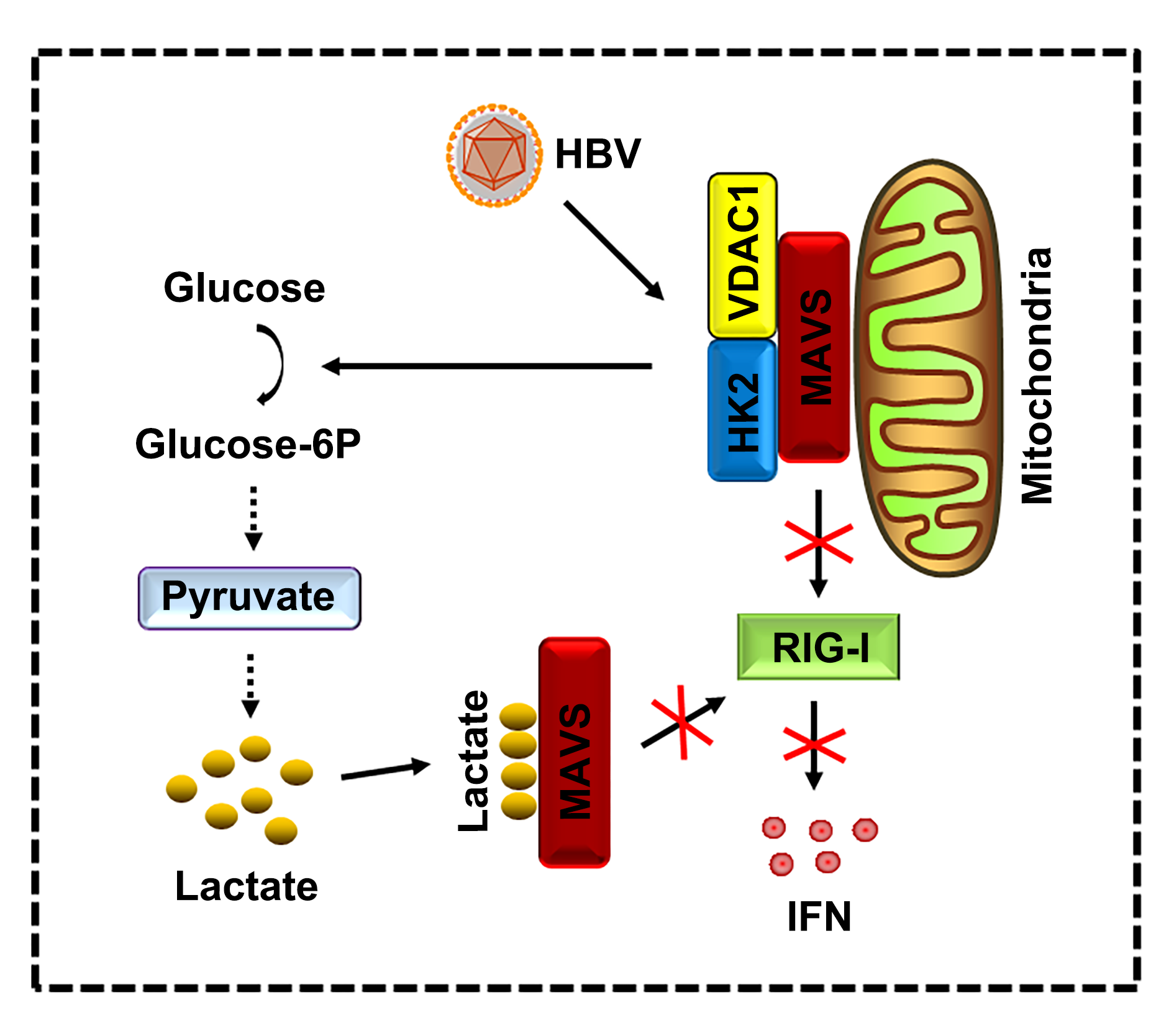
图1. HBV通过调控己糖激酶2(HK2)和乳酸抑制RIG-I样受体(RLR)信号通路。图片来源:Nat. Comm.
原文链接:
https://www.nature.com/articles/s41467-020-20316-8