近日,病毒学国家重点实验室/武汉大学基础医学院医学病毒学研究所夏宇尘教授研究组在美国胃肠病学会期刊《Cellular and Molecular Gastroenterology and Hepatology》(一区Top期刊, IF=9.225)在线发表题为“A Novel Mouse Model Harboring Hepatitis B Virus Covalently Closed Circular DNA”的研究论文。该研究通过使用腺相关病毒载体(AAV)系统将复制缺陷的线性乙肝病毒(hepatitis B virus, HBV)基因组递送进小鼠肝脏,经过宿主ATR(Ataxia-Telangiectasia and Rad3-related protein)介导的DNA损伤修复途径修复形成HBV cccDNA进而建立病毒持续复制慢性肝炎模型。该模型可通过病毒表面抗原的表达指示HBV cccDNA的形成并可用于抗病毒药物的临床前评估。
尽管有疫苗和治疗药物,乙型肝炎病毒仍在全球造成了重大的公共卫生安全负担。目前,全球约有2.57亿慢性乙肝感染者,这些患者发展为肝硬化和肝细胞癌的风险很高。现已批准用于慢性乙型肝炎治疗的两大类药物(干扰素类和核苷(酸)类似物)虽然能在一定程度上控制病毒复制,但无法彻底治愈慢性乙型肝炎,主要原因是无法彻底清除病毒复制模板- cccDNA。
由于缺乏合适的实验动物模型,HBV的基础研究和抗病毒药物开发也受到了严重阻碍。小鼠是最常用的实验动物,但它不能自然感染HBV病毒。目前,已经通过改造建立了多种用于HBV研究的小鼠模型,包括腺病毒或腺相关病毒载体介导的小鼠模型、通过高压尾静脉注射HBV复制型质粒允许HBV复制的小鼠模型和人源化肝脏嵌合小鼠模型。然而这些模型仍然受到无法模拟真实的病毒生命周期、培育困难、高成本和HBV感染后次优免疫反应等条件的限制。由于在小鼠肝细胞中HBV cccDNA不能自然形成,早期的研究也建立了几种cccDNA替代小鼠模型,如利用Cre/loxP介导的DNA重组或微环技术构建了含有重组类cccDNA分子(rcccDNA)的小鼠模型。由于在HBV基因组中插入了额外的序列(LoxP或attR),使得rcccDNA不同于真正的病毒感染时形成的cccDNA。最近有报道称,在用AAV-HBV转导的小鼠肝脏中可以检测到HBV cccDNA。然而,尚不清楚该模型中cccDNA是如何形成的以及cccDNA是否具有功能。
为了回答这些问题,夏宇尘课题组构建了HBV复制缺陷型载体pAAV-HBV1.04,该载体中插入的HBV基因组是从S基因区断开,进而形成一个编码不完整的HBV聚合酶和表面蛋白的线性HBV基因组。细胞实验结果表明,将该载体转染进Huh7细胞中可以在细胞培养上清中检测到正常表达的HBeAg,但未能检测到HBsAg和新产生的病毒粒子。然而,将该载体进行病毒包装后分别感染HepG2和AML12细胞不仅能在细胞培养上清中检测到HBeAg、HBsAg和新产生的病毒粒子,还能在细胞核中检测到形成的cccDNA。
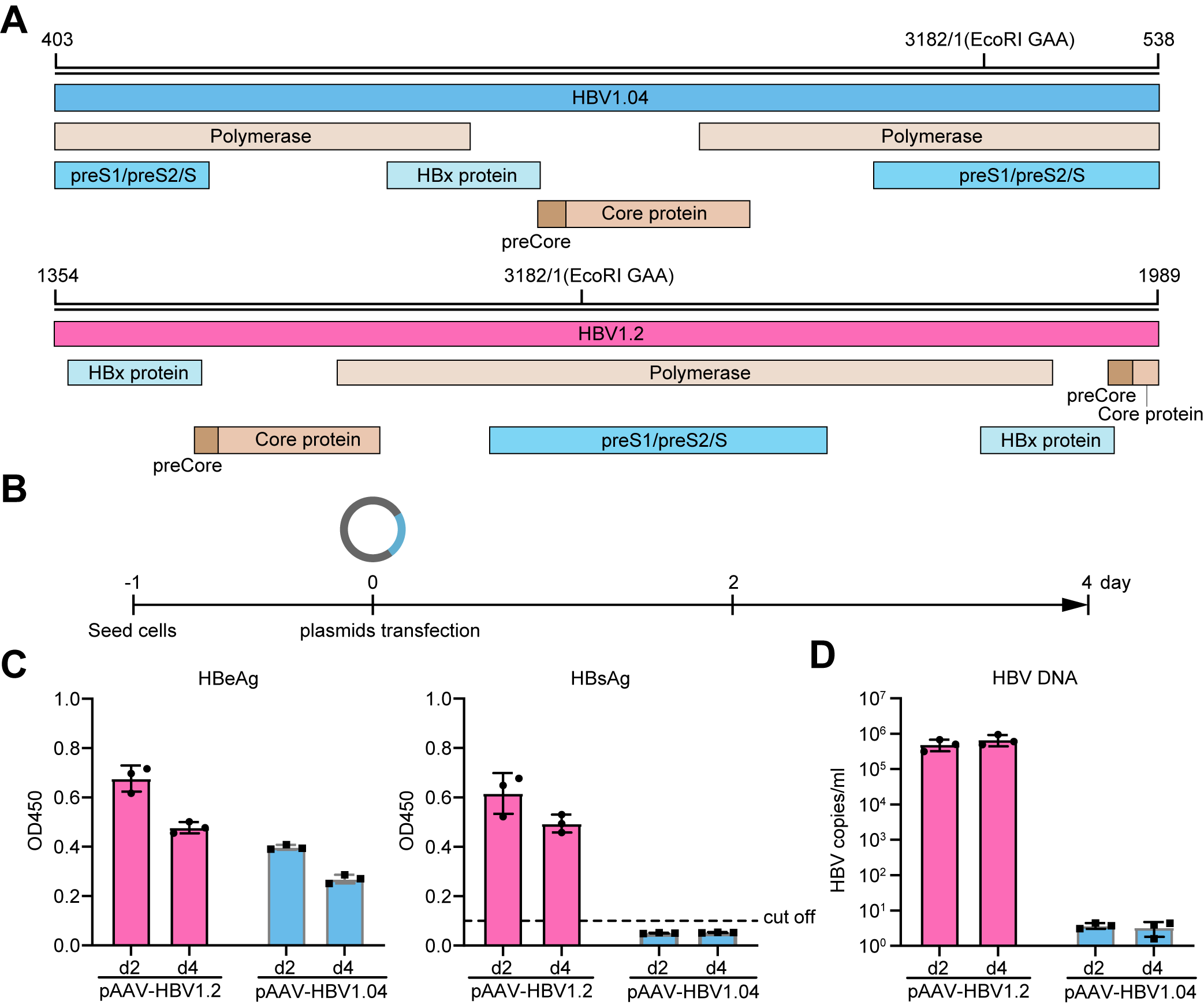
图一:pAAV-HBV1.04载体构建和验证
为探索cccDNA形成的机制,研究人员使用抗病毒药物-核衣壳抑制剂(BAY41-4109和GLS4)和RNA逆转录抑制剂恩替卡韦(ETV)进行处理,结果表明该模型中形成的cccDNA并不是由rcDNA修复而来。早期研究表明AAV感染会诱导宿主DNA损伤修复反应(DDR)。为了探究DDR酶是否参与cccDNA的形成,研究人员使用三种类型的DDR酶抑制剂:ATM抑制剂(KU-55933),ATR抑制剂(AZD6738, VE-821)和DNA-PK抑制剂(KU-57788)分别进行处理后发现ATR抑制剂处理可以显著降低了HBsAg表达水平和cccDNA的形成,说明AAV-HBV1.04病毒转导形成的HBV cccDNA是通过ATR介导的DNA损伤修复反应完成的。

图二:AAV-HBV1.04转导细胞中cccDNA的形成:该模型中形成的cccDNA并不是由rcDNA修复而来,而是通过ATR介导的DNA损伤修复反应完成的。
动物实验结果表明,通过尾静脉给小鼠注射AAV-HBV1.04病毒后可以在小鼠血清中检测到病毒抗原表达和病毒粒子且长期存在,在其肝细胞中可以检测到HBV cccDNA的形成并长期存在。这表明该系统在小鼠肝细胞中可以支持HBV cccDNA的形成。研究人员使用多种经典的cccDNA鉴定方法(T5外切酶消化,85℃热处理/+EcoRI和PCR)对cccDNA进行了鉴定并通过ChIP实验验证了该cccDNA的染色质化和转录激活功能与自然感染形成的cccDNA相同。为了检测该模型是否可用于筛选和评价抗病毒药物,研究人员使用抗病毒药物进行了验证,结果显示,ETV可以显著抑制小鼠血清中和肝细胞中的HBV DNA水平,且不影响血清中抗原和肝细胞中cccDNA水平。Poly(I:C)可以显著抑制血清中抗原水平、肝细胞中的蛋白表达水平和HBV DNA水平。这表明该AAV-HBV1.04小鼠模型适用于抗病毒药物的评价。
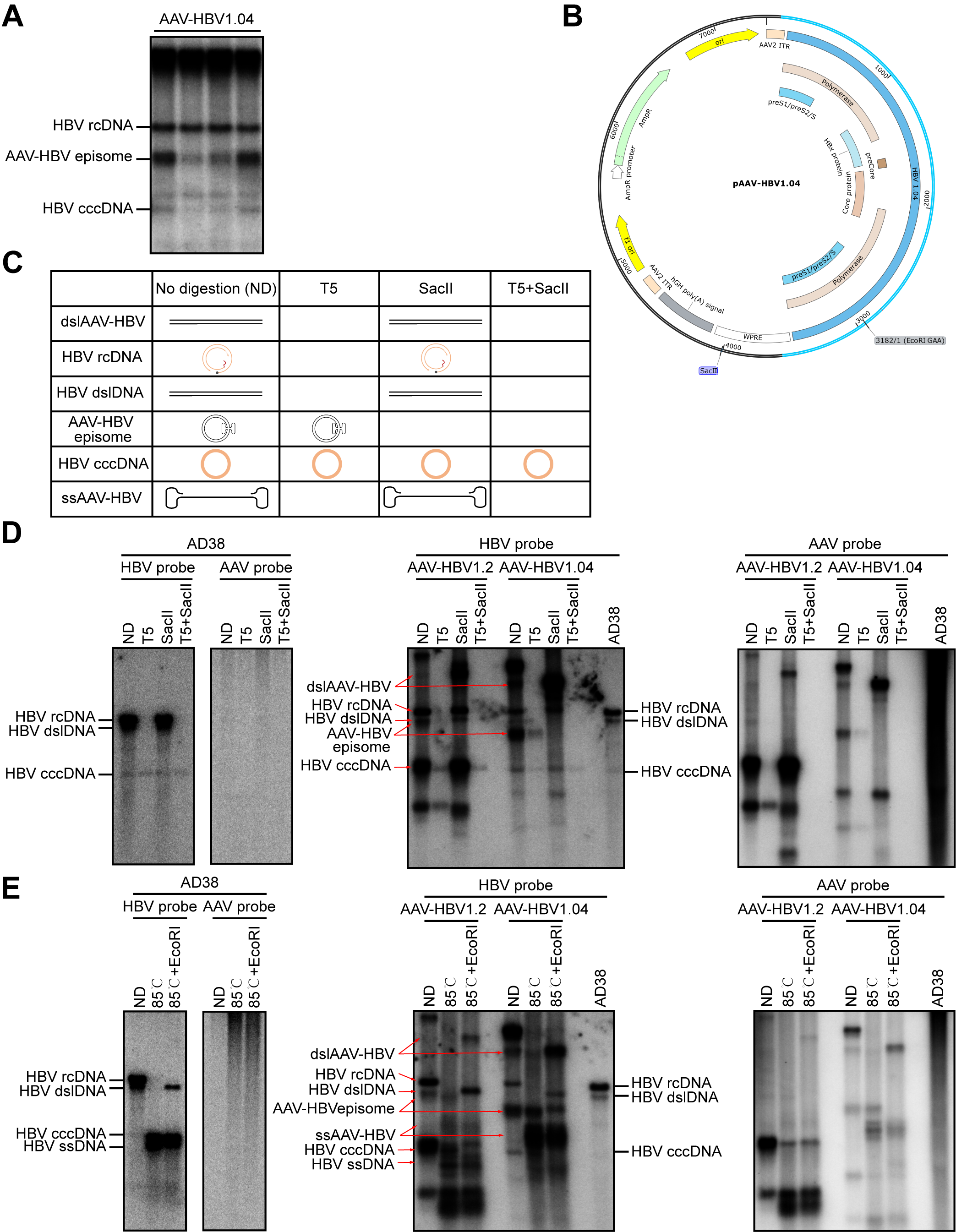
图三:AAV-HBV1.04转导小鼠中cccDNA的形成和鉴定。
该研究首次建立了一种新的含有cccDNA的HBV小鼠模型。这种小鼠模型可以通过ATR介导的DNA损伤修复反应支持HBV cccDNA的形成。由于AAV-HBV1.04载体编码不完整的HBV聚合酶和表面抗原,HBV表面抗原和HBV病毒体只能由cccDNA产生。该模型将为深入研究HBV cccDNA和开发新型抗病毒药物提供一个独特的平台。
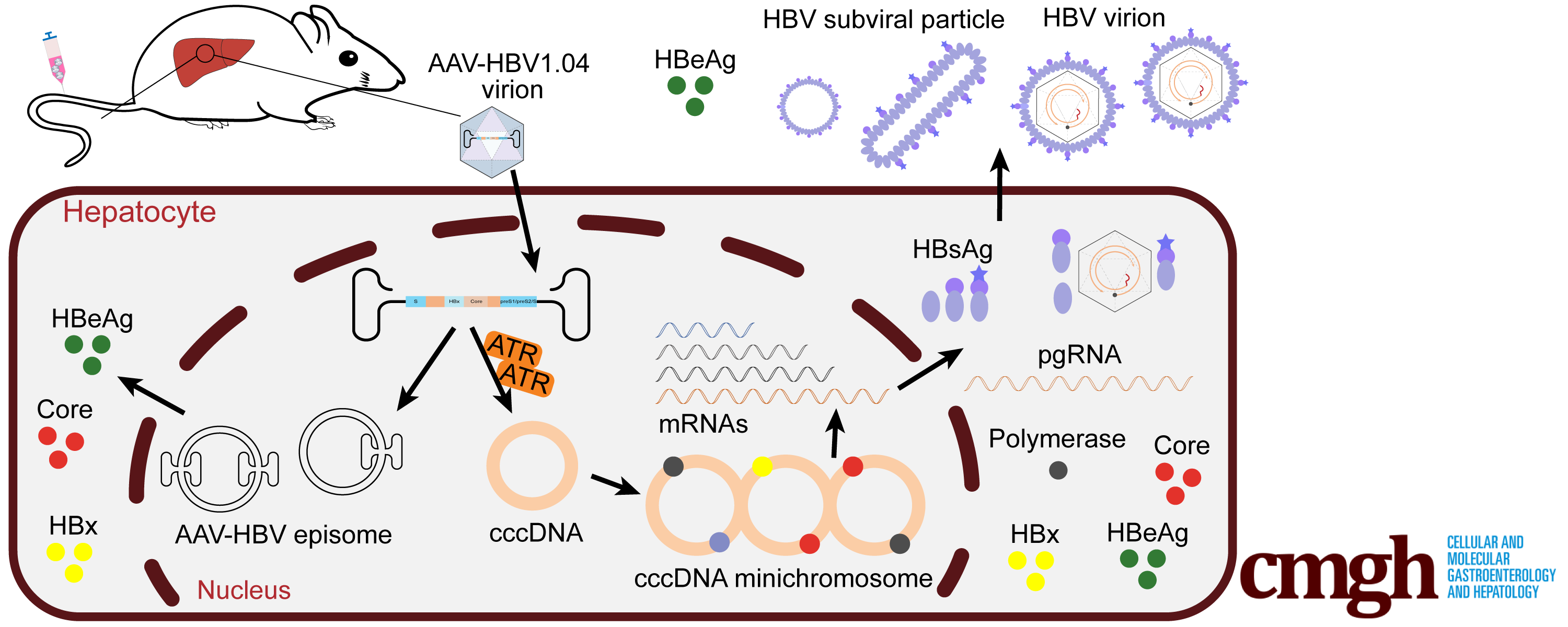
图四:AAV-HBV1.04小鼠模型示意图
该研究该工作得到国家自然科学基金 (81971936)、吉利德亚洲肝病研究基金、中央高校基本科研业务费专项资金、湖北省医学青年拔尖人才、湖北省创新研究群体(2020CFA015)、湖北省卫健委创新群体(WJ2021C002)等项目资助。武汉大学基础医学院博士研究生徐在超、赵莉、硕士研究生钟有权和武汉大学人民医院检验科祝成亮副教授为该论文共同第一作者,夏宇尘教授为通讯作者。
全文链接:https://www.cmghjournal.org/article/S2352-345X(21)00249-6/fulltext
夏宇尘教授长期从事病毒性肝炎相关研究,在乙肝病毒实验模型的建立、病毒宿主相互作用机制和新型抗病毒治疗手段上做了一系列的工作。主要研究成果在Science, Gastroenterology, Journal of Hepatology,Journal of Virology等期刊发表,多篇论文入选ESI高被引论文。担任Gastroenterology, Gut, Hepatology, Journal of Hepatology,eLIFE, Journal of Virology等杂志审稿人。实验室招收博士后1-2名,详情请联系yuchenxia@whu.edu.cn。